题目内容
室温时,向a mL 0.10mol/L的稀氨水中逐滴加入b mL 0.10mol/L的稀盐酸,试分析:
(1)滴加过程中反应的离子方程式为: .
(2)当b=a时,溶液呈 性(填“酸”“碱”或“中”),此时溶液中,c(NH4+) c(Cl-)(填“>”“<”或“=”).
(3)当溶液呈中性时,a b(填“>”“<”或“=”),此时溶液中c(NH4+) c(Cl-)
( 填“>”“<”或“=”).
(1)滴加过程中反应的离子方程式为:
(2)当b=a时,溶液呈
(3)当溶液呈中性时,a
( 填“>”“<”或“=”).
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:(1)稀氨水和稀盐酸反应生成氯化铵和水;
(2)当b=a时,二者恰好反应生成氯化铵,溶液呈酸性,根据电荷守恒判断c(NH4+)、c(Cl-)的相对大小;
(3)当溶液呈中性时,氨水应该稍微过量,据此判断a、b大小及铵根离子与氯离子浓度大小.
(2)当b=a时,二者恰好反应生成氯化铵,溶液呈酸性,根据电荷守恒判断c(NH4+)、c(Cl-)的相对大小;
(3)当溶液呈中性时,氨水应该稍微过量,据此判断a、b大小及铵根离子与氯离子浓度大小.
解答:
解:(1)稀盐酸和稀氨水反应生成氯化铵和水,反应的离子方程式为:NH3?H2O+H+═NH4++H2O,故答案为:NH3?H2O+H+═NH4++H2O;
(2)当b=a时,二者恰好反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,c(H+)>c(OH-),根据电荷守恒知:c(NH4+)<c(Cl-),故答案为:酸;<;
(3)要使混合溶液呈中性,c(H+)=c(OH-),则氨水应该稍微过量,所以a>b,根据电荷守恒知,此时溶液中c(NH4+)=c(Cl-),故答案为:>;=.
(2)当b=a时,二者恰好反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,c(H+)>c(OH-),根据电荷守恒知:c(NH4+)<c(Cl-),故答案为:酸;<;
(3)要使混合溶液呈中性,c(H+)=c(OH-),则氨水应该稍微过量,所以a>b,根据电荷守恒知,此时溶液中c(NH4+)=c(Cl-),故答案为:>;=.
点评:本题考查了盐类水解原理、酸碱混合溶液定性判断等知识,根据盐类水解特点、酸碱混合溶液酸碱性等知识点来分析解答,注意守恒思想的运用,题目难度中等.

练习册系列答案
相关题目
将氯化钠、乙醇、碘分别从以下三种混合物中分离出来,①食盐水②乙醇溶液③碘水( )
| A、蒸馏、萃取、蒸发 |
| B、萃取、蒸馏、蒸发 |
| C、蒸发、萃取、蒸馏 |
| D、蒸发、蒸馏、萃取 |
下列从海水中提取镁正确的方法是( )(提示:熔点:MgO2 850℃MgCl2 714℃)
A、海水
| ||||||
B、海水
| ||||||
C、海水
| ||||||
D、海水
|
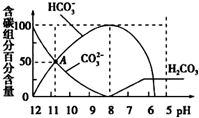 常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )
常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )| A、0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C、常温下CO2饱和溶液的pH约为5.6 |
| D、当加入20 mL盐酸时,混合溶液的pH约为8 |
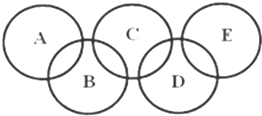 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:


