题目内容
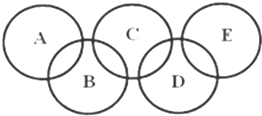 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:(1)B的水溶液呈弱酸性,其主要的电离方程式可表示为
(2)E电子式为
(3)液态B与液态E反应可生成一种气态单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式为
(4)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.试写出E与足量盐酸反应时,发生反应的化学方程式
考点:无机物的推断
专题:推断题
分析:A是沼气的主要成分,为甲烷;B分子中所含电子数为18,B不稳定,具有较强的氧化性,含有氢元素,可知B为H2O2;C中含有O元素,C是光导纤维的主要材料,故C为SiO2;E分子中所含电子数为18,E是由六个原子构成的分子,依据分子结构和化学键的特征分析,形成三个化学键的原子为氮原子,故E中含有H元素和N元素,E为N2H4;D中含有Si元素,还含有H元素或N元素,由D中所含的两种元素的原子个数之比为3:4,故D为Si3N4.
解答:
解:A是沼气的主要成分,为甲烷;B分子中所含电子数为18,B不稳定,具有较强的氧化性,含有氢元素,可知B为H2O2;C中含有O元素,C是工业制玻璃的主要原料之一,故C为SiO2;E分子中所含电子数为18,E是由六个原子构成的分子,原子平均电子数为3,故E中含有H元素,E为N2H4;D中含有Si元素,还含有H元素或N元素,由D中所含的两种元素的原子个数之比为3:4,故D为Si3N4;判断A为CH4,B为H2O2,C为SiO2,D为Si3N4;E为N2H4;
(1)B为H2O2的水溶液呈弱酸性,属于二元弱酸,其主要的电离方程式可表示为:H2O2?HO2-+H+;依据判断D为Si3N4;
故答案为:H2O2?HO2-+H+;Si3N4;
(2)E为N2H4;电子式为: ;故答案为:
;故答案为: ;
;
(3)液态B为H2O2,液态E为N2H4;BE反应可生成一种气态单质和一种常见液体,依据组成元素分析,气体为氮气,液体为水,1molB参加反应放出热量QkJ,反应热化学方程式为:2H2O2(l)+N2H4(l)=N2(g)+4H2O(l)△H=-2QKJ/mol;
故答案为:2H2O2(l)+N2H4(l)=N2(g)+4H2O(l)△H=-2QKJ/mol;
(4)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.E为N2H4 与足量盐酸时,分子中含有两对孤对电子,和盐酸发生反应的化学方程式:N2H4+2HCl=N2H6Cl2
故答案为:N2H4+2HCl=N2H6Cl2
(1)B为H2O2的水溶液呈弱酸性,属于二元弱酸,其主要的电离方程式可表示为:H2O2?HO2-+H+;依据判断D为Si3N4;
故答案为:H2O2?HO2-+H+;Si3N4;
(2)E为N2H4;电子式为:
 ;故答案为:
;故答案为: ;
;(3)液态B为H2O2,液态E为N2H4;BE反应可生成一种气态单质和一种常见液体,依据组成元素分析,气体为氮气,液体为水,1molB参加反应放出热量QkJ,反应热化学方程式为:2H2O2(l)+N2H4(l)=N2(g)+4H2O(l)△H=-2QKJ/mol;
故答案为:2H2O2(l)+N2H4(l)=N2(g)+4H2O(l)△H=-2QKJ/mol;
(4)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.E为N2H4 与足量盐酸时,分子中含有两对孤对电子,和盐酸发生反应的化学方程式:N2H4+2HCl=N2H6Cl2
故答案为:N2H4+2HCl=N2H6Cl2
点评:本题考查物质的推断,电子式、化学方程式的书写方法,难度较大,掌握常见18电子物质是推断的关键,需要学生对常见物质的结构与性质熟练掌握.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
下列关于实验安全的叙述中不正确的是( )
| A、实验室制备有毒气体应在通风橱中进行,且必须对尾气进行吸收或处理,防止中毒或污染大气 |
| B、不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖 |
| C、氢气还原氧化铜,一般先预热氧化铜,然后通入氢气 |
| D、眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 |
在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol?L-1.下列判断错误的是( )
| A、平衡常数约为0.3 |
| B、B的转化率为40% |
| C、A的平均反应速率为0.3 mol?(L?min)-1 |
| D、若混合气体的相对分子质量不变则表明该反应达到平衡状态 |