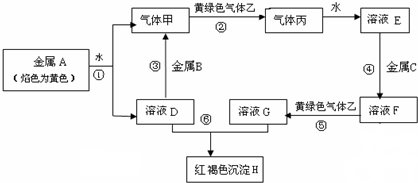
题目内容
15.经最简单的历程由溴乙烷制乙二醇,没有涉及到的反应类型是( )| A. | 氧化反应 | B. | 加成反应 | C. | 消去反应 | D. | 取代反应 |
分析 由溴乙烷制乙二醇,发生CH2Br-CH3+NaOH$→_{△}^{醇}$CH2=CH2+H2O+NaBr、CH2=CH2+Br2→CH2BrCH2Br、CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$CH2OHCH2OH+2NaBr,以此来解答.
解答 解:经最简单的历程由溴乙烷制乙二醇,发生CH2Br-CH3+NaOH$→_{△}^{醇}$CH2=CH2+H2O+NaBr、CH2=CH2+Br2→CH2BrCH2Br、CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$CH2OHCH2OH+2NaBr,分别为消去反应、加成反应、取代反应,没有涉及氧化反应,
故选A.
点评 本题考查有机物的合成,为高频考点,把握合成反应中官能团变化、有机反应类型为解答的关键,侧重分析与应用能力的考查,注意卤代烃、烯烃的性质,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
5.下表为元素周期表的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题.
(1)化学性质最不活泼的元素的原子结构示意图为
(2)元素⑧的名称为溴,其最高价氧化物的水化物的化学式为HBrO4
(3)用电子式表示元素②与元素⑨形成化合物的过程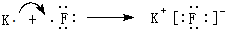
(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K (填元素符号);元素①的一种氧化物中既含有离子键又有共价键,它的电子式是
(5)①、③、⑨三种元素形成的简单离子半径由大到小的顺序为F->Na+>Mg2+(用离子符号表示)
(6)元素③和⑦形成的化合物与水能剧烈反应,其反应的实质是阴阳离子分别与水电离产生的H+和OH-离子重新组合,生成新的物质,写出该反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑩ | ||||
| 4 | ② | ④ | ⑧ |

(2)元素⑧的名称为溴,其最高价氧化物的水化物的化学式为HBrO4
(3)用电子式表示元素②与元素⑨形成化合物的过程

(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K (填元素符号);元素①的一种氧化物中既含有离子键又有共价键,它的电子式是

(5)①、③、⑨三种元素形成的简单离子半径由大到小的顺序为F->Na+>Mg2+(用离子符号表示)
(6)元素③和⑦形成的化合物与水能剧烈反应,其反应的实质是阴阳离子分别与水电离产生的H+和OH-离子重新组合,生成新的物质,写出该反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
6.如图所示,电极a与b均为石墨棒,在电解过程中,下列说法正确的是( )
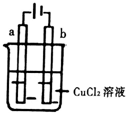

| A. | 电极a表面呈红色 | |
| B. | 电极b作阳极 | |
| C. | 电子由电源的正极沿导线流向电极a | |
| D. | 当电路中通过0.2mol电子时,理论上b电极质量增加6.4g |
3.下列分子或离子中采用sp3杂化,但是V形结构的是( )
| A. | NH3 | B. | H2S | C. | BeCl2 | D. | NO3- |
10.下列是消去反应的是( )
| A. | 乙烯使酸性KMnO4褪色 | B. | 溴乙烷在NaOH乙醇溶液中加热 | ||
| C. | 乙醛的银镜反应 | D. | 溴乙烷在NaOH水溶液中加热 |
7.下列叙述正确的是( )
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 共价化合物也能含有离子键 | |
| D. | 离子化合物不能含有共价键 |
5.下列实验可达到目的是( )
| A. | 将苯与浓硝酸、浓硫酸的混合物在60℃水浴加热条件下反应可生成硝基苯 | |
| B. | 用酸性高锰酸钾可以检验CH2=CH-CHO中碳碳双键 | |
| C. | 将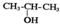 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| D. | 向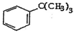 中通入足量的酸性高锰酸钾溶液可以得到 中通入足量的酸性高锰酸钾溶液可以得到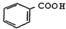 |
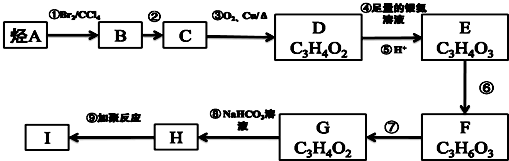
 .
.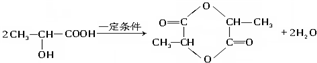 .
.