题目内容
恒温恒容时,NO2和N2O4之间发生反应N2O4(g)?2NO2(g),如图所示.
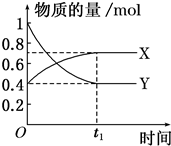
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间变化的曲线.
(2)若升高温度,则v(正) ,v(逆) (填“加快”或“减慢”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol?(L?min)-1,乙中v(N2O4)=0.2mol?(L?min)-1,则 容器中反应更快.

(1)曲线
(2)若升高温度,则v(正)
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol?(L?min)-1,乙中v(N2O4)=0.2mol?(L?min)-1,则
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据物质的量的变化量之比等于计量数之比分析;
(2)根据温度对反应速率的影响分析;
(3)根据反应速率之比等于化学计量数之比比较.
(2)根据温度对反应速率的影响分析;
(3)根据反应速率之比等于化学计量数之比比较.
解答:
解:(1)由方程式N2O4(g)?2NO2 (g),可知反应中NO2 的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
(2)温度升高,正逆反应速率都增大,故答案为:加快;加快;
(3)甲中v(NO2)=18mol/(L?min),乙中v (N2O4)=0.2mol?L-1?min-1,v(NO2)=2v(N2O4)=0.4mol?L-1?s-1=24mol/(L?min),则乙反应较快,
故答案为:乙.
(2)温度升高,正逆反应速率都增大,故答案为:加快;加快;
(3)甲中v(NO2)=18mol/(L?min),乙中v (N2O4)=0.2mol?L-1?min-1,v(NO2)=2v(N2O4)=0.4mol?L-1?s-1=24mol/(L?min),则乙反应较快,
故答案为:乙.
点评:本题考查较为综合,题目难度中等,注意把握化学反应速率以及化学平衡的基本知识即可解答该题.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
能正确表示下列反应的离子方程式的是( )
| A、金属铝溶于稀硫酸中:Al+2H+=Al3++H2↑ | ||
B、碳酸钙溶于稀硝酸中:CO
| ||
| C、铁加入硫酸铜溶液中:2Fe+Cu2+=2Fe2++Cu | ||
| D、氢氧化钡溶液和盐酸反应:H++OH-=H2O |
下列物质是由3种氨基酸分子脱水缩合生成的四肽的结构简式:

这种四肽彻底水解时,不可能产生的氨基酸是( )

这种四肽彻底水解时,不可能产生的氨基酸是( )
A、 |
B、 |
| C、NH2-CH2-COOH |
D、 |
在1-18号元素中(稀有气体元素除外),能形成最稳定气态氢化物的元素是 ;与水或酸反应最剧烈的金属单质是 ;最高价氧化物的水化物中碱性最强是 ;最高价氧化物的水化物中酸性最强是 .(全部填写元素符号)
下列说法不能证明氯的非金属性比硫强的是( )
| A、HCl比H2S稳定 |
| B、HClO4的酸性比H2SO4的酸性强 |
| C、向Na2S溶液中通入Cl2,溶液变浑浊 |
| D、向新制氯水中滴加Na2SO3溶液,氯水褪色 |
 (1)根据要求完成下列问题:
(1)根据要求完成下列问题: