题目内容
3.工业产生的废气COX、NOX、SOX 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝.(1)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=-akJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-b kJ•mol-1;
CH3OH(g)═CH3OH(l)△H=-c kJ•mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$b+2c-a-d)kJ•mol-1.
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)?COCl2(g)制备.图1为此反应的反应速率随温度变化的曲线,图2为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线.回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=0.15mol•L-1•min-1;
②10min改变的条件是升高温度,该反应平衡常数变化的趋势是减小(填“增大”、“减小”或“不变”).
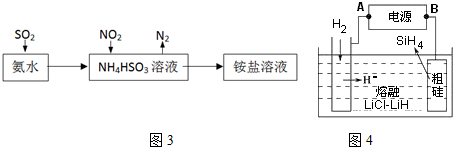
(3)利用氨水可以将SO2和NO2吸收,原理如图3所示:NO2被吸收的离子方程式是2NO2+4HSO3-═N2+4SO42-+4H+.
(4)用粗硅作原料,熔融盐电解法制取硅烷原理如图4,判断B为电源的正极,电解时阳极的电极反应式为Si+4H--4e-═SiH4↑.
分析 (1)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H=-b kJ•mol-1;
③H2O(g)═H2O(l)△H=-c kJ•mol-1;
④CH3OH(g)═CH3OH(l)△H=-d kJ•mol-1,
由盖斯定律可知,②×$\frac{3}{2}$+③×2-①-④得到CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l);
(2)①由图可知,△c(Cl2)=1.2mol/L-0.3mol/L,结合v=$\frac{△c}{△t}$计算;
②由图可知,第10 min时平衡逆向移动,据影响平衡移动的因素分析,升温平衡向逆反应方向移动,平衡常数减小;
(3)二氧化氮具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,二氧化氮被还原为氮气;
(4)电解池中的阳极上发生失电子的氧化反应,单质硅失电子后和H-结合生成SiH4;
解答 解:(1)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H=-b kJ•mol-1;
③H2O(g)═H2O(l)△H=-c kJ•mol-1;
④CH3OH(g)═CH3OH(l)△H=-d kJ•mol-1,
由盖斯定律可知,②×$\frac{3}{2}$+③×2-①-④得到CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$b+2c-a-d)kJ•mol-1,
则CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$b+2c-a-d)kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$b+2c-a-d)kJ•mol-1;
(2)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L-0.3mol/L=0.9mol/L,则v(Cl2)=$\frac{0.9mol/L}{6min}$=0.15 mol•L-1•min -1,
故答案为:0.15 mol•L-1•min-1 ;
②影响平衡移动的因素有温度、浓度和压强,该反应是放热反应,由图可知,第10 min时平衡逆向移动,只能是升温,由图1可知,升温平衡向逆反应方向移动,正反应为放热反应,所以温度高,平衡常数减小,
故答案为:升高温度;减小;
(3)二氧化氮具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,二氧化氮被还原为氮气,离子方程式:2NO2+4HSO3-=N2+4SO42-+4H+;
故答案为:2NO2+4HSO3-═N2+4SO42-+4H+;
(4)从图示知,粗硅变化为SiH4,失电子发生氧化反应,B为电源的正极,H-移向阳极生成SiH4,电极反应式为Si+4H--4e-=SiH4↑,
故答案为:正; Si+4H--4e-═SiH4↑;
点评 本题考查硅及其化合物的性质,读懂图象、理顺平衡常数与转化率间的关系、注意电化学电极反应式的书写是解题的关键,题目难度中等.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案| A. | 标准状况下,0.1molCl2溶于足量NaOH溶液,转移的电子数目为0.1NA | |
| B. | 0.2mol/LCaCl2溶液中含有Cl-离子的数目为0.4NA | |
| C. | 标准状况下,11.2lCCl4中含有分子的数目为0.5NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目0.1NA |
| A. | 1 mol H2的质量只有在标准状况下才约为2 g | |
| B. | 在标准状况下,某气体的体积是22.4 L,则可认为该气体的物质的量约是1 mol | |
| C. | 在20℃时,1 mol任何气体的体积总比22.4 L大 | |
| D. | 1 mol H2和O2的混合气体,在标准状况下的体积大于22.4 L |
| A. | 2FeCO3(s)+O2(g)=Fe2O3(s)+2CO2(g)△H=-130 KJ/mol | |
| B. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol | |
| C. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol | |
| D. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+130 KJ/mol |
| 时间(min) | 0 | 5 | 10 | 15 | 20 |
| c(CO2)(mol/L) | 0.00 | 0.02 | 0.03 | 0.03 | 0.03 |
(2)在体积不变的条件下,改变下列条件能使平衡常数变大的是A
A.升高温度 B.降低温度 C.加入催化剂 D.移出二氧化碳气体
(3)如要一开始加入0.04mol的CO、0.04mol的H2O、0.08mol的CO2和0.08mol的H2,在相同的条件下,反应达平衡时,c(CO)=0.03mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.12mol 的水蒸气,重新达到平衡后,CO的转化率升高(填“升高”、“降低”还是“不变”),CO2的质量分数降低(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,重新投料,测得在某一时刻c(CO)=c(H2O)=0.09mol/L,c(CO2 )=c(H2)=0.13mol/L,则此时v(正)<v(逆)(用“>”、“<”或“=”作答)
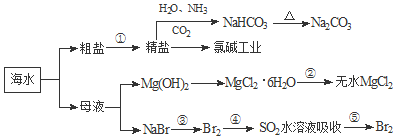
| A. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| B. | 工业生产上向母液中加石灰乳使Mg2+转化为Mg(OH)2沉淀 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
