题目内容
溶液中氧化剂XO-3有2×10-3mol,与30mL0.1mol/LNa2SO3 溶液恰好反应完全,则还原产物中元素X的价态是( )
| A、+3 | B、+2 | C、+1 | D、0 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:该反应中XO-3和Na2SO3 发生氧化还原反应,亚硫酸根离子被氧化生成硫酸根离子,XO-3作氧化剂,则X元素得电子化合价降低,再结合转移电子守恒计算还原产物中X化合价.
解答:
解:该反应中XO-3和Na2SO3 发生氧化还原反应,亚硫酸根离子被氧化生成硫酸根离子,XO-3作氧化剂,则X元素得电子化合价降低,n(Na2SO3 )=0.1mol×0.03L=0.003mol,设还原产物中X化合价为a,氧化还原反应中转移电子相等,所以
0.003mol×(6-4)=2×10-3mol×(5-a),a=+2,故选B.
0.003mol×(6-4)=2×10-3mol×(5-a),a=+2,故选B.
点评:本题考查氧化还原反应计算,根据氧化还原反应中转移电子相等进行计算即可,侧重考查氧化还原知识的灵活运用,题目难度不大.

练习册系列答案
相关题目
分别燃烧下列各组物质中的两种有机化合物,所得CO2和H2O的物质的量之比相同的有( )
| A、乙烯、丁二烯 |
| B、乙醇、乙醚 |
| C、苯、苯酚 |
| D、醋酸、葡萄糖 |
下列措施或事实不是因平衡移动引起的是( )
| A、新制的氯水在光照下颜色变浅 |
| B、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| C、H2、I2、HI平衡混合气加压后颜色变深 |
| D、在合成氨的反应中,加压有利于氨的合成 |
根据如图,下列判断中正确的是( )
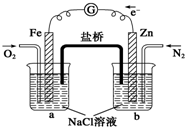

| A、烧杯a中的溶液pH不变 |
| B、烧杯a中发生氧化反应 |
| C、烧杯b中发生的反应为Zn-2e-=Zn2+ |
| D、烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
下列哪一项是通过降低反应所需的能量和增加活化分子的百分数来加快反应速率的( )
| A、增大物质的量浓度 |
| B、增大压强 |
| C、升高温度 |
| D、使用催化剂 |
下列应用涉及的反应属于非氧化还原反应的是( )
A、 在如图所示装置中制氨气 |
| B、利用铝热反应焊接铁轨 |
| C、通过合成氨实现人工固氮 |
| D、过氧化钠用作呼吸面具的供氧剂 |
实验室制Cl2的反应为4HCl(浓)+MnO2═MnCl2+C12↑+2H2O,下列说法错误的是( )
| A、还原剂是HCl,氧化剂是MnO2 |
| B、每生成1 molCl2,转移电子的物质的量为2 mol |
| C、每消耗1 molMnO2,起还原剂作用的HCl消耗4mol |
| D、生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
一定量的铜和浓硫酸在加热条件下充分反应:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.向反应后显酸性的溶液只能逐滴加入含amolNaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是( )
| ||
| A、溶液中c(Na+)=2c(SO42-) | ||
B、沉淀的物质的量等于
| ||
| C、标况下,生成SO2的体积<11.2aL | ||
D、原浓硫酸中H2SO4的物质的量>
|
碳酸铵[(NH4)2CO3]室温下能自发地分解产生氨气,对其说法正确的是( )
| A、碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大 |
| B、碳酸铵分解是因为外界给予了能量 |
| C、该反应的△H-T△S>0 |
| D、碳酸盐都不稳定,都能自发分解 |