题目内容
20.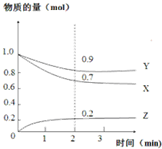 某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是( )
某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是( )| A. | 该反应的化学方程式:3X+Y?2Z | |
| B. | 反应开始至2min,Z的平均反应速率:0.1mol/(L•min) | |
| C. | 若在3min后,把Z从反应体系中分离,平衡不移动 | |
| D. | 用X表示该化学反应速率比用Y表示的要快 |
分析 A、随反应进行反应物的物质的量减小,生成物的物质的量增大.反应结束反应物的物质的量为定值,反应为可逆反应,根据物质的量之比等于化学计量数之比,书写方程式.
B、根据v=$\frac{△c}{△t}$计算以Z表示的平均反应速率;
C.若在3min后,把Z从反应体系中分离,减少生成物浓度,平衡正向进行;
D.同一反应不同物质表示反应速率不同,但表示的意义相同.
解答 解:A、由图可知随反应进行X、Y的物质的量变小,Z的物质的量变大,所以X、Y为反应物,z为生成物,反应结束各物质的物质的量不变,所以反应为可逆反应,X、Y、Z的化学计量数之比为(1-0.7)mol:(1-0.9)mol:0.2mol=3:1:2,所以反应方程式为3X+Y?2Z,故A正确;
B、由图可知2min内Z的物质的量变化量为0.2mol,所以2min内以Z表示的平均反应速率v(Z)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),故B错误;
C.X、Y、Z三种气态物质,若在3min后,把Z从反应体系中分离,减少生成物浓度平衡正向进行,故C错误;
D.用X表示该化学反应速率和用Y表示的反应速率数值不同,但反应的速率表示的意义相同,故D错误;
故选A.
点评 本题考查了化学反应速率概念的理解和计算,主要是图象的分析应用,注意同一反应本题物质速率可能不同,但表达意义相同,题目难度中等.

练习册系列答案
相关题目
11.下列反应,属于熵减过程的是( )
| A. | CO(g)═C(s)+$\frac{1}{2}$O2(g) | B. | 2N2O5(g)═4NO2(g)+O2(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |
8.下列各组离子能在某酸性的无色溶液中大量共存的是( )
| A. | NH4+、Mg2+、SO42-、Cl- | B. | K+、Cl-、HCO3-、SO42 | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Ca2+、S2-、Na+、NO3- |
15.在无色透明强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Fe3+、SO42-、NO3- | B. | K+、Fe2+、ClO-、CO32- | ||
| C. | Al3+、Na+、NO3-、Cl- | D. | K+、Na+、AlO2-、Cl- |
5.下列化学式与指定物质的主要成分对应正确的是( )
| A. | CH4--天然气 | B. | CaO--熟石灰 | C. | Na2CO3--小苏打 | D. | NaHCO3--苏打粉 |
12.如图是钠晶体的晶胞结构,则晶胞中的原子数是( )


| A. | 2 | B. | 4 | C. | 3 | D. | 5 |
9.将pH为5的硫酸溶液稀释500倍,稀释后溶液中c(H+):c(SO42-)约为( )
| A. | 10:1 | B. | 1:10 | C. | 2:1 | D. | 1:1 |
 B.
B. C.
C. D.
D.