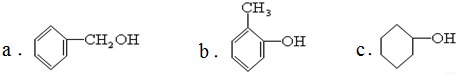
题目内容
9.将pH为5的硫酸溶液稀释500倍,稀释后溶液中c(H+):c(SO42-)约为( )| A. | 10:1 | B. | 1:10 | C. | 2:1 | D. | 1:1 |
分析 稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离,所以将pH=5的硫酸溶液稀释500倍后,溶液中的SO42-的浓度成比例下降,但H+浓度降到10-7mol/L便不再下降.
解答 解:pH为5的溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=5×10-6mol/L,
溶液稀释500倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=1×10-8mol/L,
所以稀释后溶液中氢离子与硫酸根离子的浓度之比为:1×10-7mol/L:1×10-8mol/L=10:1,故选A.
点评 本题考查了溶液pH的计算方法,题目难度中等,注意掌握溶液中氢离子、氢氧根离子浓度与溶液pH的关系,明确酸溶液稀释后不可能变成碱溶液.

练习册系列答案
相关题目
20.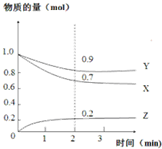 某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是( )
某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是( )
 某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是( )
某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是( )| A. | 该反应的化学方程式:3X+Y?2Z | |
| B. | 反应开始至2min,Z的平均反应速率:0.1mol/(L•min) | |
| C. | 若在3min后,把Z从反应体系中分离,平衡不移动 | |
| D. | 用X表示该化学反应速率比用Y表示的要快 |
17.下列事实不能用勒夏特列原理解释的是( )
| A. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| B. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| C. | 用排饱和食盐水法收集氯气 | |
| D. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
4.以下物质间的转化不能通过一步反应实现的是( )
| A. | HCl→Cl2 | B. | NH3→NO | C. | S→SO2 | D. | SiO2→H2SiO3 |
14.在蒸发皿中加热蒸干并灼烧(低于 300℃)下列物质的溶液,可以得到该固体溶质的是( )
| A. | 氯化铝 | B. | 亚硫酸钠 | C. | 硫酸镁 | D. | 碳酸氢钠 |
1.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32ˉ+CO2+H2O═H2SiO3↓+CO32ˉ | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2ˉ+4NH4++2H2O | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32ˉ+2H+═SO2↑+H2O |
18.下列四组物质中,互为同位素是( )
| A. | O2和O3 | B. | H216O和H218O | C. | 12C和14C | D. | 正丁烷和异丁烷 |
 b.烯烃
b.烯烃  c.炔烃
c.炔烃