题目内容
有关SiO2+2C
Si+2CO↑的反应,下列说法正确的是( )
| ||
| A、SiO2是还原剂 |
| B、氧化剂与还原剂的质量比为1:2 |
| C、生成1molSi此反应中电子转移4mol |
| D、CO是还原产物 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中Si元素化合价由+4价变为0价、C元素化合价由0价变为+2价,再结合还原剂、氧化剂、氧化产物、还原产物的概念及物质间的关系来分析解答.
解答:
解:A.该反应中Si元素化合价由+4价变为0价、C元素化合价由0价变为+2价,所以二氧化硅是氧化剂,故A错误;
B.该反应中Si元素化合价由+4价变为0价、C元素化合价由0价变为+2价,所以二氧化硅是氧化剂、碳是还原剂,氧化剂和还原剂的物质的量之比是1:2,其质量之比=(1×60):(2×12)=5:2,故B错误;
C.该反应中Si元素化合价由+4价变为0价、C元素化合价由0价变为+2价,该反应中生成1molSi此反应中电子转移的物质的量=1mol×(4-0)=4mol,故C正确;
D.CO是氧化产物,故D错误;
故选C.
B.该反应中Si元素化合价由+4价变为0价、C元素化合价由0价变为+2价,所以二氧化硅是氧化剂、碳是还原剂,氧化剂和还原剂的物质的量之比是1:2,其质量之比=(1×60):(2×12)=5:2,故B错误;
C.该反应中Si元素化合价由+4价变为0价、C元素化合价由0价变为+2价,该反应中生成1molSi此反应中电子转移的物质的量=1mol×(4-0)=4mol,故C正确;
D.CO是氧化产物,故D错误;
故选C.
点评:本题考查了氧化还原反应,明确元素化合价是解本题关键,根据化合价变化、物质间的关系及基本概念来分析解答,题目难度不大.

练习册系列答案
相关题目
X、Y是原子序数大于4的两种主族元素,它们的离子Xm+和Yn-具有相同的核外电子排布.有关X、Y的叙述不正确的是( )
| A、原子序数大小:X>Y |
| B、Xm+和Yn-离子半径大小:Yn-<Xm+ |
| C、在周期表中X、Y在不同周期 |
| D、在周期表中X、Y的族序数之差为:8-(m+n) |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、电解精炼铜时,若转移了NA个电子,则阴极析出32g铜 |
| B、标准状态下,33.6L氟化氢中含有1.5NA个氟化氢分子 |
| C、0.1mol/L的Al2(SO4)3溶液中,Al3+的数目小于0.2NA |
| D、1mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
下列化学反应的离子方程式正确的是( )
A、在稀氨水中通入过量CO2:NH3?H2O+CO2=N
| ||||
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | ||||
C、向Ba(OH)2溶液中加入少量的NaHSO3溶液2HS
| ||||
| D、氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
氰化物有剧毒,在碱性条件下可用如下方法进行处理:2CN-+12OH-+5Cl2=2CO
+N2+10Cl-+6H2O,则下列判断中,不正确的是( )
2- 3 |
| A、上述反应中的氧化剂是Cl2 |
| B、该反应过程中只有氮元素被氧化 |
| C、还原性:CN->Cl- |
| D、当有1 molCl2参加反应时,转移的电子数为2mol |
下列有关说法不正确的是( )
| A、根据化合物在水溶液或熔融状态下是否导电,将化合物分为电解质和非电解质 |
| B、氨气的水溶液能够导电,因此NH3是电解质 |
| C、电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关 |
| D、溶液与胶体的本质区别是分散质颗粒直径大小 |
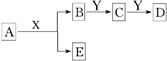 中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )| A、若A是CaC2,X是H2O,则Y一定是溴水 |
| B、若A是金属钠,X是H2O,则E一定能还原Fe2O3 |
| C、若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应 |
| D、若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应 |
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答: