题目内容
 已知25℃时,几种难溶电解质的溶度积如下表所示:
已知25℃时,几种难溶电解质的溶度积如下表所示:| 化学式 | AgCl | Ag2S | AgOH |
| 溶度积(K甲 ) | 1.8×10-10 | 6.3×10-50 | 1.5×10-8 |
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:根据沉淀溶解平衡常数:Ksp越小的越先形成沉淀,根据离子反应实质和图中数据来计算回答即可.
解答:
解:溶液中的反应为S2-+2Ag+=Ag2S↓,Cl-+Ag+=AgCl↓,由图象可知,先生成硫化银沉淀后生成氯化银沉淀,加入V1体积硝酸银,硫离子沉淀完全,则n(S2-)=
c(AgNO3)×V1,加入V2体积的硝酸银,氯离子沉淀完全,则n(Cl-)=c(AgNO3)×(V2-V1),体积相同,浓度之比等于物质的量之比,所以原溶液中原溶液中
=
=
,故选D.
| 1 |
| 2 |
| [S2-] |
| [Cl-] |
| ||
| [AgNO3]?[V2-V1] |
| V1 |
| 2(V2-V1) |
点评:本题考查学生难溶电解质的溶解平衡以及沉淀转化的知识,可以根据教材知识来回答,难度不大.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
已知:①卤代烃在一定条件下可发生水解反应生成醇.②醇可被强氧化剂氧化生成羧酸.CH2BrCH=CHCH2Br可经三步反应制取HOOCCH(Cl)CH2COOH,发生反应的类型依次是( )
| A、水解反应、加成反应、氧化反应 |
| B、加成反应、水解反应、氧化反应 |
| C、水解反应、氧化反应、加成反应 |
| D、加成反应、氧化反应、水解反应 |
在25℃下,将a mol?L-1的醋酸(HAc)与0.01mol?L-1的氢氧化钠溶液等体积混合,反应平衡时溶液呈中性.则下列说法中,不正确的是( )
| A、此时醋酸和氢氧化钠溶液恰好中和 | ||
| B、溶液中存在未电离的醋酸分子 | ||
C、用含a的代数式表示醋酸(HAc)的电离常数为Ka=
| ||
| D、a肯定大于0.01 |
下列说法错误的是( )
| A、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| B、硅酸盐NaAISiO4.nH2O可改写成氧化物形式为:Na2O.AI2O3.2SiO2.2nH2O |
| C、AI65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大 |
| D、过量铁与浓硫酸加热反应可以得到氢气 |
用硫铁矿生产硫酸的过程中,对提高效率不利的因素是( )
| A、矿石粉碎后送入沸腾炉 |
| B、使用热交换器预热气体 |
| C、使用催化剂 |
| D、用水吸收三氧化硫 |
下列事实不能用勒夏特列原理解释的是( )
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入NaOH溶液后,溶液颜色变浅 |
| B、对2HI(g)?H2(g)+I2(g)平衡体系,增大压强可使颜色变深 |
| C、反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 |
| D、工业合成氨工艺中,采用较高的压强来提高原料的转化率 |
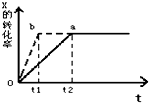 图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )
图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )| A、增大Y的浓度 |
| B、加入催化剂 |
| C、降低温度 |
| D、增大体系压强 |
下列电离或水解方程式正确的是( )
| A、Na2SO3的水解:SO3 2-+2H2O?H2SO3+2OH- |
| B、NaHCO3的电离:NaHCO3?Na++H++CO3 2- |
| C、KHS的电离:KHS=K++HS- |
| D、NaClO溶液与FeCl2溶液混合:2ClO-+Fe2++2H2O=2HClO+Fe(OH)2↓ |