题目内容
下列事实不能用勒夏特列原理解释的是( )
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入NaOH溶液后,溶液颜色变浅 |
| B、对2HI(g)?H2(g)+I2(g)平衡体系,增大压强可使颜色变深 |
| C、反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 |
| D、工业合成氨工艺中,采用较高的压强来提高原料的转化率 |
考点:化学平衡移动原理
专题:化学平衡专题
分析:勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答:
解:A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,Br-+Ag+═AgBr↓,溴离子浓度减小,使平衡Br2+H2O?HBr+HBrO正移,溴水的浓度减小,颜色变浅,能用勒夏特列原理解释,故A不选;
B、H2、I2、HI三者的平衡,增大压强平衡不移动,但浓度增大,则颜色加深,不能用勒夏特列原理解释,故B选;
C、反应CO+NO2?CO2+NO,△H<0,升高温度,向着吸热方向进行,即可使平衡向逆反应方向移动,能用勒夏特列原理解释,故C不选;
D、合成氨反应正方向为体积减小的方向,加压有利于平衡正移,能用勒夏特列原理解释,故C不选;
故选B.
B、H2、I2、HI三者的平衡,增大压强平衡不移动,但浓度增大,则颜色加深,不能用勒夏特列原理解释,故B选;
C、反应CO+NO2?CO2+NO,△H<0,升高温度,向着吸热方向进行,即可使平衡向逆反应方向移动,能用勒夏特列原理解释,故C不选;
D、合成氨反应正方向为体积减小的方向,加压有利于平衡正移,能用勒夏特列原理解释,故C不选;
故选B.
点评:本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.

练习册系列答案
相关题目
在实验室里进行分液操作,下列实验仪器中一定需要使用的是( )
| A、容量瓶 | B、分液漏斗 |
| C、玻璃棒 | D、温度计 |
将一小块钠放入下列溶液中,既能产生气体又能生成白色沉淀的是( )
| A、硝酸铜溶液 | B、稀硫酸 |
| C、氯化钠溶液 | D、氯化镁溶液 |
 已知25℃时,几种难溶电解质的溶度积如下表所示:
已知25℃时,几种难溶电解质的溶度积如下表所示:| 化学式 | AgCl | Ag2S | AgOH |
| 溶度积(K甲 ) | 1.8×10-10 | 6.3×10-50 | 1.5×10-8 |
A、
| ||
B、
| ||
C、
| ||
D、
|
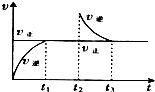 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H>0,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H>0,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )| A、Z和W在该条件下一定不为气态 |
| B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C、若在该温度下此反应平衡常数表达式为K=C(X),则t1~t2时间段与t3时刻后的X浓度相等 |
| D、该反应的平衡常数K随温度升高而增大 |
在体积相同的A、B两个带活塞的玻璃容器中,分别注入
体积颜色相同的NO2与溴蒸气,然后将活塞同时向外拉出到
(快速),过一会可以看到( )
| 1 |
| 4 |
| 1 |
| 2 |
| A、A中的颜色比B中的浅 |
| B、A中的颜色比B中的深 |
| C、A中的颜色与B中的深浅相同 |
| D、A中颜色比开始时深 |
取两份铝片,第一份与足量硫酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为( )
| A、2:3 | B、1:1 |
| C、3:2 | D、1:3 |
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A、在自然界中只以化合态的形式存在 |
| B、单质常用作半导体材料和光导纤维 |
| C、最高价氧化物不与任何酸反应 |
| D、气态氢化物很稳定,受热不易分解 |
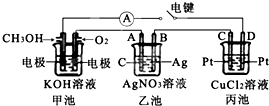 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题: