题目内容
11.设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的是( )| A. | 分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢 | |
| B. | 分别向等质量的白色粉末中加等体积适量的水,比较固体溶解量的多少 | |
| C. | 分别配成溶液,加入澄清石灰水,比较是否有沉淀生成 | |
| D. | 分别将等质量的白色粉末加热,将产生的气体通入澄清石灰水中看是否变浑浊 |
分析 A.等量的碳酸氢钠与等体积、等浓度的盐酸反应快些;
B.碳酸钠和碳酸氢钠在等温时的溶解度的不同,碳酸氢钠的溶解度较小;
C.二者与Ca(OH)2反应,均生成白色沉淀;
D.碳酸氢钠受热分解,而碳酸钠不分解.
解答 解:A.等量的碳酸氢钠与等体积、等浓度的盐酸反应快些,可鉴别碳酸钠和碳酸氢钠,故A正确;
B.碳酸氢钠的溶解度较小,分别向等量的白色粉末中加等体积适量的水,比较固体溶解量的多少,可以鉴别二者,故B正确;
C.Na2CO3和NaHCO3均可与澄清石灰水反应产生白色沉淀,故加入澄清石灰水比较是否有沉淀生成的方法不能鉴别两白色粉末,故C错误;
D.加热碳酸氢钠分解放出CO2与澄清石灰水生成沉淀,碳酸钠加热不易分解,可以进行鉴别,故D正确,
故选C.
点评 本题考查物质的检验和鉴别,把握物质性质的差异为解答的关键,注意利用不同性质来鉴别物质,注重基础知识的考查,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
1.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4 g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 1 mol MgCl2固体溶于水中,所得氯离子的数目为NA | |
| D. | 17 g氨气所含电子数目为10NA |
2.密度为0.91g/cm3的氨水,质量分数为50%,该氨水用等体积的水稀释后,所得溶液里溶质的质量分数为( )
| A. | 等于25% | B. | 大于25% | C. | 小于25% | D. | 无法确定 |
19.瓦斯中甲烷与氧气的体积比为1:2 时极易爆炸,此时甲烷与氧气的质量比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
6.P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 ( )
| A. | NH3 | B. | HI | C. | SO2 | D. | CO2 |
16.某有机物的蒸气完全燃烧时,需要三倍于其体积的O2,产生二倍于其体积的CO2,则该有机物可能是(体积在同温同压下测定)( )
| A. | C2H2 | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
3.水在273K、1.01×105Pa时可转化为固态,在373K时则又可转化为气态.若分别用S(g)、S(1)、S(s)表示水的气、液、固三种状态的熵值,则下列表达式中,正确的是( )
| A. | S(g)<S(1)<S(s) | B. | S(g)>S(1)>S(s) | C. | S(g)>S(1)=S(s) | D. | S(g)>S(s)>S(1) |
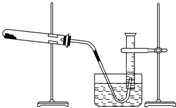 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下: