题目内容
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,没有使用的仪器和用品有
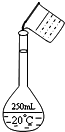
(2)在配制的转移过程中某学生进行如右图操作,请指出其中的错误:
(3)在容量瓶使用方法中,下列操作不正确的是
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用碱液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)实验中还需要2mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是
A.1000mL,80g B.950mL,76g C.任意规格,72g D.500mL,42g
(5)在配制NaOH溶液实验中,下列操作会使配制的溶液浓度偏低的是
A.没有将洗涤液转移到容量瓶 B.NaOH溶液未冷却即转移至容量瓶中
C.容量瓶洗净后未干燥 D.定容时仰视刻度线.
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)依据配置一定物质的量浓度溶液的基本步骤选择仪器;
(2)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,配制多大体积的溶液要采用多大体积的容量瓶;
(3)依据容量瓶使用的注意事项解答;
A.溶液配制过程中需要将容量瓶颠倒摇匀;
B.用碱液润洗容量瓶相当于多加溶质氢氧化钠;
C.氢氧化钠具有腐蚀性不能用滤纸称量,氢氧化钠溶解放热易炸裂容量瓶;
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀;
(4)依据实验室常用的容量瓶规格解答,利用n=cV、m=n×M来计算NaOH的质量,计算时溶质应按照容量瓶所标体积计算;
(5)根据c=
分析判断,凡是导致n偏小或者V偏大的操作,所配溶液浓度偏低,凡是导致n偏大或者V偏小的操作,所配溶液浓度偏高.
(2)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,配制多大体积的溶液要采用多大体积的容量瓶;
(3)依据容量瓶使用的注意事项解答;
A.溶液配制过程中需要将容量瓶颠倒摇匀;
B.用碱液润洗容量瓶相当于多加溶质氢氧化钠;
C.氢氧化钠具有腐蚀性不能用滤纸称量,氢氧化钠溶解放热易炸裂容量瓶;
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀;
(4)依据实验室常用的容量瓶规格解答,利用n=cV、m=n×M来计算NaOH的质量,计算时溶质应按照容量瓶所标体积计算;
(5)根据c=
| n |
| V |
解答:
解:(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌加速溶解,冷却后用玻璃棒引流转移到500mL容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加到凹液面与刻度线相切,摇匀,装瓶,贴标签,没有使用的仪器和用品有②100mL量筒,还缺少的仪器是:胶头滴管;
故答案为:②;胶头滴管;
(2)在移液时,要用玻璃棒引流,右图该同学在转移溶液时没有用玻璃棒引流,配制500mL的溶液要采用500mL的容量瓶,
故答案为:未用玻璃棒引流;容量瓶规格使用错误;
(3)A.溶液配制过程中需要将容量瓶颠倒摇匀,所以在使用前应检查是否漏水,故A正确;
B.用碱液润洗容量瓶相当于多加溶质氢氧化钠,所配的溶液浓度偏大,故B错误;
C.氢氧化钠具有腐蚀性要用小烧杯称量,氢氧化钠溶解放出大量的热,应该冷却后再转移到容量瓶,故C错误;
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀,故D正确;
故答案为:BC;
(4)实验室没有950mL容量瓶,要配置2mol/L的NaOH溶液950mL,应选用比950ml稍大的1000ml的容量瓶,
所需溶质的质量m=C×V×M=1L×2mol/L×40g/mol=80.0g,
故答案为:A;
(5)根据c=
可知:
A.没有将洗涤液转移到容量瓶,导致转移到容量瓶的溶质的物质的量偏小,根据浓度公式可知,所配溶液浓度偏低,故A正确;
B.NaOH溶与水释放大量的热,溶液有热涨冷缩的性质,未冷却即转移至容量瓶中,将导致溶液的体积偏小,根据根据浓度公式可知,所配溶液浓度偏高,故B错误;
C.定容时还需向容量瓶中加入水,所以容量瓶洗净后未干燥,对实验无影响,故C错误;
D.定容时仰视刻度线,将导致加入的蒸馏水偏多,溶液的体积偏大,根据浓度公式可知,所配溶液浓度偏低,故D正确;
故答案为:AD.
故答案为:②;胶头滴管;
(2)在移液时,要用玻璃棒引流,右图该同学在转移溶液时没有用玻璃棒引流,配制500mL的溶液要采用500mL的容量瓶,
故答案为:未用玻璃棒引流;容量瓶规格使用错误;
(3)A.溶液配制过程中需要将容量瓶颠倒摇匀,所以在使用前应检查是否漏水,故A正确;
B.用碱液润洗容量瓶相当于多加溶质氢氧化钠,所配的溶液浓度偏大,故B错误;
C.氢氧化钠具有腐蚀性要用小烧杯称量,氢氧化钠溶解放出大量的热,应该冷却后再转移到容量瓶,故C错误;
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀,故D正确;
故答案为:BC;
(4)实验室没有950mL容量瓶,要配置2mol/L的NaOH溶液950mL,应选用比950ml稍大的1000ml的容量瓶,
所需溶质的质量m=C×V×M=1L×2mol/L×40g/mol=80.0g,
故答案为:A;
(5)根据c=
| n |
| V |
A.没有将洗涤液转移到容量瓶,导致转移到容量瓶的溶质的物质的量偏小,根据浓度公式可知,所配溶液浓度偏低,故A正确;
B.NaOH溶与水释放大量的热,溶液有热涨冷缩的性质,未冷却即转移至容量瓶中,将导致溶液的体积偏小,根据根据浓度公式可知,所配溶液浓度偏高,故B错误;
C.定容时还需向容量瓶中加入水,所以容量瓶洗净后未干燥,对实验无影响,故C错误;
D.定容时仰视刻度线,将导致加入的蒸馏水偏多,溶液的体积偏大,根据浓度公式可知,所配溶液浓度偏低,故D正确;
故答案为:AD.
点评:配制一定物质的量浓度溶液是高中阶段非常重要的实验,也是高考常考的知识点,侧重培养学生正确使用化学仪器,规范实验操作的能力,题目难度中等.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、1L 0.1mol?L-1的乙酸溶液中含有的氧原子数0.2NA |
| B、标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA |
| C、标准状况下,23g CH3CH2OH中含有的分子数目为0.5NA |
| D、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
进行化学实验时必须要有安全意识,下列做法错误的是( )
| A、被玻璃割伤手后,先取出伤口里的玻璃片,再用稀双氧水擦洗,然后敷药包扎 |
| B、苯酚沾在皮肤上应立即用酒精擦洗(提示:苯酚具有强烈腐蚀性,易溶于酒精) |
| C、温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 |
| D、酒精灯碰倒洒出酒精着火,迅速用湿抹布扑盖 |