题目内容
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、1L 0.1mol?L-1的乙酸溶液中含有的氧原子数0.2NA |
| B、标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA |
| C、标准状况下,23g CH3CH2OH中含有的分子数目为0.5NA |
| D、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.水分子中也含有氧原子;
B.根据氟化氢的沸点是19.54℃,标况下不是气体;
C.利用N=n×NA来计算分子数;
D.氯气与水反应为可逆反应;
B.根据氟化氢的沸点是19.54℃,标况下不是气体;
C.利用N=n×NA来计算分子数;
D.氯气与水反应为可逆反应;
解答:
解:A.因水分子中也含有氧原子,1L 0.1mol?L-1的乙酸溶液中含有的氧原子数大于0.2NA,故A错误;
B.由于氟化氢的沸点是19.54℃,标况下氟化氢不是气体,无法计算33.6L氟化氢的物质的量,故B错误;
C.标准状况下,23g CH3CH2OH的物质的量为
=0.5mol,分子数目为0.5NA,故C正确;
D.氯气与水反应为可逆反应,1molCl2溶于水,反应的氯气小于1mol,转移的电子数目小于0.1NA,故D错误;
故选C.
B.由于氟化氢的沸点是19.54℃,标况下氟化氢不是气体,无法计算33.6L氟化氢的物质的量,故B错误;
C.标准状况下,23g CH3CH2OH的物质的量为
| 23g |
| 46g/mol |
D.氯气与水反应为可逆反应,1molCl2溶于水,反应的氯气小于1mol,转移的电子数目小于0.1NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用概念理解,微粒数计算,气体摩尔体积的条件应用,物质性质的分析判断是解题关键.题目难度中等.

练习册系列答案
相关题目
平衡常数的大小可以表示反应进行的程度,平常常数大说明( )
| A、反应物平衡浓度较大 |
| B、反应物平衡浓度较小 |
| C、生成物平衡浓度较大 |
| D、生成物平衡浓度较小 |
下列关于原电池的叙述中正确的是( )
| A、在镁、铝、稀NaOH溶液组成的原电池中,镁是负极,铝是正极 |
| B、在铁、铝、稀硫酸组成的原电池中,电子由铁片通过导线流向铝片 |
| C、在锌、铜、稀硫酸组成的原电池中,当电池工作时,硫酸根离子向正极移动 |
| D、在锌、铜、CuSO4溶液组成的原电池中,负极质量减轻,正极质量增加 |
洗涤做过银镜反应的试管,最好选用下列试剂中的( )
| A、浓氨水 | B、盐酸溶液 |
| C、稀硝酸溶液 | D、浓烧碱溶液 |
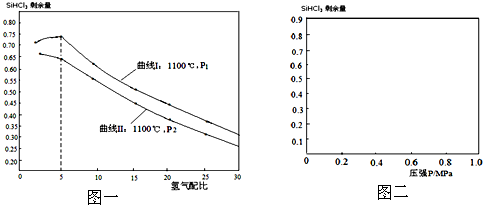
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有: