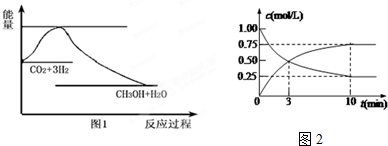
题目内容
11.某同学设计了如下实验,以尽可能多地使二氧化氮被水吸收.(1)把一支充满NO2的试管倒放在盛有水的水槽中,发现红棕色气体逐渐消失,水位上升,最后水大约会充满整个试管的$\frac{1}{3}$,试管上部剩余无色气体.该过程中发生反应的化学方程式为3NO2+H2O═2HNO3+NO
(2)加热氯酸钾和二氧化锰的混合物以制取氧气,并保存在储气瓶中.该过程发生反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
分析 (1)根据NO2的颜色、易溶于水的物理性质以及NO2和H2O反应生成一氧化氮和硝酸等解答;
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,由此解答;
解答 解:(1)由于红棕色的NO2易溶于水,发生反应3NO2+H2O═2HNO3+NO,故气体颜色消失,3molNO2反应生成1molNO,气体体积减少到原先的$\frac{1}{3}$,故液面上升至容积的$\frac{2}{3}$处,故答案为:红棕;$\frac{1}{3}$;无;3NO2+H2O═2HNO3+NO;
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,故答案为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
点评 本题考查了氮的氧化物的性质、化学方程式的书写,题目难度中等,注意掌握氮的氧化物的性质,明确氧化还原反应的实质及配平方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
19.氯气是一种化学性质很活泼的单质,它具有较强的氧化性,下列叙述中不正确的是( )
| A. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| B. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰 | |
| C. | 氯气通入品红溶液中,溶液会褪色,是因为氯气具有漂白性 | |
| D. | 氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
16.下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是:( )
①Al ②Fe3O4③NaHCO3 ④Al(OH)3⑤Na2CO3.
①Al ②Fe3O4③NaHCO3 ④Al(OH)3⑤Na2CO3.
| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③④ |
1.用NA表示阿伏加德罗常数的数值.下列叙述正确的是( )
| A. | 100mL0.1mol•L-1FeCl3溶液中含有Fe3+的数目为0.01NA | |
| B. | 在铜与单质硫的反应中,1mol铜失去的电子数为2NA | |
| C. | 15.6g由Na2S和Na2O2组成的固体混合物中,含有的阴离子数为0.2NA | |
| D. | 104g苯乙烯(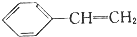 )中含有碳氢键的数目和碳碳双键的数目分别为8NA和4NA )中含有碳氢键的数目和碳碳双键的数目分别为8NA和4NA |