题目内容
1.用NA表示阿伏加德罗常数的数值.下列叙述正确的是( )| A. | 100mL0.1mol•L-1FeCl3溶液中含有Fe3+的数目为0.01NA | |
| B. | 在铜与单质硫的反应中,1mol铜失去的电子数为2NA | |
| C. | 15.6g由Na2S和Na2O2组成的固体混合物中,含有的阴离子数为0.2NA | |
| D. | 104g苯乙烯(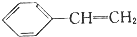 )中含有碳氢键的数目和碳碳双键的数目分别为8NA和4NA )中含有碳氢键的数目和碳碳双键的数目分别为8NA和4NA |
分析 A.Fe3+离子在溶液中部分水解,导致Fe3+的数目减少;
B.铜与S单质反应生成的是硫化亚铜,1mol铜完全反应失去1mol电子;
C.过氧化钠中阴离子为过氧根离子,二者的摩尔质量都是78g/mol;
D.苯乙烯分子中含有8个C-H键和1个碳碳双键.
解答 解:A.100mL0.1mol•L-1FeCl3溶液中含有溶质氯化铁的物质的量为:0.1mol/L×0.1L=0.01mol,由于Fe3+部分水解,则溶液中含有Fe3+的数目小于0.01NA,故A错误;
B.在铜与单质硫的反应中,生成产物为氯化亚铜,1mol铜完全反应失去1mol电子,失去的电子数为NA,故B错误;
C.Na2S和Na2O2的摩尔质量都为78g/mol,则15.6g二者的混合物的物质的量为:$\frac{15.6g}{78g/mol}$=0.2mol,过氧化钠中的阴离子为过氧根离子,硫化钠中的阴离子为硫离子,则0.2mol混合物中含有0.2mol阴离子,含有的阴离子数为0.2NA,故C正确;
D.104g苯乙烯的物质的量为:$\frac{104g}{104g/mol}$=1mol,1mol苯乙烯分子中含有8molC-H键和1mol碳碳双键,含有碳氢键的数目和碳碳双键的数目分别为8NA和NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系为解答关键,D为易错点,注意苯乙烯分子中含有1个碳碳双键.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
16.在10mL试管中集瞒了N02和N2的混合气体,把试管倒置在水槽中,水面上升,最后剩余6mL气体,由此可以说明( )
| A. | 原试管有4mL NO2 | B. | 6mL气体全部是N2 | ||
| C. | 原试管有6mL NO2 | D. | 剩余6mL气体是NO和N2的混合气体 |
1.鲨烯是一种高度不饱和烃类化合物,最初是从鲨鱼的肝油中发现的,分子中含有多个双键,分子式为C30H5,关于角鲨烯有下列叙述:①能使酸性KMnO4溶液褪色 ②能与氢气发生加成反应 ③角鲨烯只含碳、氢两种元素④角鲨烯易被氧化其中正确的是( )
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
8.糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述不正确的是( )
| A. | 淀粉水解的最终产物是葡萄糖 | |
| B. | 蛋白质只含有C、H、O三种元素 | |
| C. | 油脂在碱性条件下水解可制肥皂 | |
| D. | 葡萄糖与新制氢氧化铜悬浊液共沸有砖红色沉淀产生 |
6.下列关于物质的检验方法正确的是( )
| A. | 向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42- | |
| B. | 某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水 | |
| C. | 向某白色固体粉末中滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原固体粉末中一定含CO32-或HCO3- | |
| D. | 将某白色固体粉末与氢氧化钠浓溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,证明原固体中一定含有NH4+ |
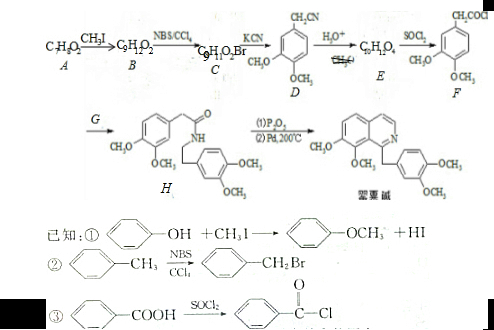
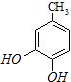 ;C分子中的官能团有醚键和溴原子.(填名称)
;C分子中的官能团有醚键和溴原子.(填名称)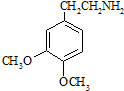 .
.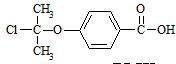 .
.