题目内容
8.在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O下列叙述中正确的是( )| A. | 反应中KMnO4被氧化 | |
| B. | HCl发生还原反应 | |
| C. | 每生成1 mol Cl2时,反应中转移的电子为2 mol | |
| D. | 氧化剂与还原剂的物质的量之比为5:1 |
分析 2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:A.Mn元素的化合价降低,则反应中KMnO4被还原,故A错误;
B.Cl元素的化合价升高,则HCl发生氧化反应,故B错误;
C.每生成1mol Cl2时,反应中转移的电子为1mol×2×[0-(-1)]=2 mol,故C正确;
D.2molKMnO4作氧化剂得到电子与10molHCl作还原剂失去电子相同,则氧化剂和还原剂的比是1:5,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
18.欲将NaCl、沙子(主要成份SiO2)、I2晶体的混合物分离,最科学的操作顺序是( )
| A. | 溶解、结晶、过滤、升华 | B. | 加热(升华)、溶解、过滤、蒸发(结晶) | ||
| C. | 加热(升华)、溶解、蒸馏、结晶 | D. | 溶解、过滤、加热(升华)、蒸发(结晶) |
19.下列说法不正确的是( )
| A. | 乙烯、乙醇均能使酸性高锰酸钾溶液褪色 | |
| B. | 通过乙烷的取代反应或乙烯的加成反应都可以制取纯净的氯乙烷 | |
| C. | 乙烯、环己烷都属于烃类,它们通式相同,但它们不互为同系物 | |
| D. | 烯烃完全燃烧时,生成CO2和H2O的物质的量相等 |
3.下列各组物质,互为同系物的是( )
| A. | CH3-CH=CH2与  | B. |  与 与 | ||
| C. | 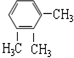 与 与 | D. | CH3CH2Cl 与CH3CHCl-CH2Cl |
13.下列关于强、弱电解质的叙述,正确的是( )
| A. | 浓硫酸是强电解质 | |
| B. | 弱电解质在水溶液中一定不能完全电离 | |
| C. | 强电解质的水溶液中不存在分子 | |
| D. | 弱电解质溶液的导电能力一定很弱 |
20.一定条件下,体积为1L的密闭容器中,2mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 若增大压强,则混合气体的平均分子量减小 | |
| B. | 将容器体积变为0.5 L,Z的平衡浓度变为原来的2倍 | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 保持体积不变,向其中充入1 mol He气体,平衡右移 |
17.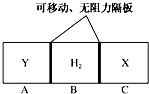 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )| A. | X、Y均为气体单质 | |
| B. | X、Y的相对分子质量相等 | |
| C. | n(H2)<n(X)=n(Y) | |
| D. | 隔板停止滑动时,A、B、C三部分体积相等 |
6.NiSO4是一种重要的化工原料,大量用于电镀、触媒和纺织品染色等.某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al、Fe的单质及氧化物,其他不溶杂质.

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、漏斗、玻璃棒外还需要的主要仪器为蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑,Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)在40℃左右,用6%的H2O2能氧化Fe2+此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀而把铁除去.图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾钠稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).下列说法正确的是CD(选填序号).

A.FeOOH中铁为+2价
B.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
C.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O
D.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(5)操作b调节pH的范围为3.2-7.1.
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、漏斗、玻璃棒外还需要的主要仪器为蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑,Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)在40℃左右,用6%的H2O2能氧化Fe2+此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀而把铁除去.图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾钠稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).下列说法正确的是CD(选填序号).

A.FeOOH中铁为+2价
B.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
C.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O
D.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(5)操作b调节pH的范围为3.2-7.1.
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.