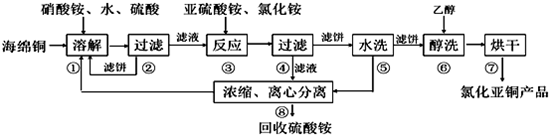
题目内容
9.如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.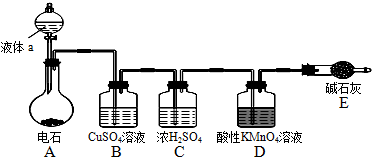
(1)写出实验室制取乙炔的化学方程式:CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)实验室制取乙炔时,分液漏斗中的液体a通常是饱和食盐水.
(3)CuSO4溶液的作用是吸收杂质气体硫化氢.
(4)装置D中的现象是:高锰酸钾溶液褪色.
(5)工业上常用乙炔、饱和食盐水等物质作原料来合成聚氯乙烯,请写出相关方程式:
2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑
Cl2+H2=2HCl
C2H2+HCl→CH2=CHCl
nCH2=CHCl→
 .
.
分析 A装置利用电石与水反应制乙炔,电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率,实验室制得的乙炔中含杂质硫化氢、磷化氢,会对乙炔性质实验造成干扰,用装置B除去,乙炔含有碳碳三键,能与高锰酸钾溶液反应使其褪色,据此分析解答.
解答 解:(1)电石与水反应生成乙炔和氢氧化钙,化学反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率,
故答案为:饱和食盐水;
(3)此反应中会产生杂质气体,硫化氢、磷化氢,会对乙炔性质实验造成干扰,利用硫酸铜溶液吸收硫化氢气体,以避免干扰,
故答案为:吸收杂质气体硫化氢;
(4)乙炔含有碳碳三键,能与高锰酸钾溶液反应使其褪色,
故答案为:高锰酸钾溶液褪色;
(5)聚氯乙烯的单体是氯乙烯,饱和食盐水的作用是电解制取氯气,化学反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,Cl2+H2=2HCl,C2H2+HCl→CH2=CHCl,氯乙烯加聚反应生成聚氯乙烯:nCH2=CHCl→ ,
,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、Cl2+H2=2HCl、C2H2+HCl→CH2=CHCl、nCH2=CHCl→ .
.
点评 本题考查了物质性质的探究实验分析判断,掌握实验基本操作和实验设计方法是解题关键,注意乙炔的除杂和性质实验以及聚氯乙烯的合成,题目难度中等.

练习册系列答案
相关题目
20.下列物质直接排放不会引起环境污染的是( )
| A. | 甲醛 | B. | 苯酚 | C. | 氮气 | D. | 二氧化硫 |
17.过氧化钙(CaO2)难溶于水,广泛应用于渔业、农业、环保等许多方面.
I.CaO2的制备:
(1)①在低温下,往过氧化氢浓溶液中投入无水氯化钙发生复分解反应,写出该可逆反应的化学方程式H2O2+CaCl2 CaO2+2HCl.
CaO2+2HCl.
②为控制低温的方式,最好将反应器放置在冰水浴中.
③测得不同温度下,过氧化钙的平均生成速率如下表所示:
请解释速率随温度如此变化的原因40℃之前,温度升高,速率加快;40℃之后,温度继续升高,双氧水分解,浓度下降,反应速率减慢.
(2)一段时间后,再加入氨水,当调节溶液pH至9~11,才出现大量沉淀.用简要的文字解释需用氨水调节pH至9~11的原因NH3•H2O结合HCl,使反应H2O2+CaCl2 CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.
CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.
II.CaO2的热稳定性:CaO2在一定温度下能发生可逆反应,生成CaO和O2.
(3)标准生成热的定义为:在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下1mol某纯物质的热效应.已知,CaO2和CaO的标准生成热分别为a kJ•mol-1和b kJ•mol-1,请书写CaO2分解生成CaO和O2的热化学方程式2CaO2(s) 2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.
2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.
(4)一定温度下,在2L的恒容容器中进行该反应,反应过程中各物质的物质的量如下表所示:
则该温度下,反应的化学平衡常数K=0.25mol/L.
(5)3s时,若对该容器压缩体积,其它条件不变,则当再次达到平衡时,氧气的浓度不变(填“变大”、“变小”、“不变”、“无法确定”),理由是温度不变,该反应的平衡常数K=c(CO2)=0.25mol/L不变.
(6)下列说法不能说明该反应达到平衡的是a(填字母).
a.气体的密度不再改变 b.固体质量不再改变
c.正反应速率不再改变 d.逆反应速率不再改变.
I.CaO2的制备:
(1)①在低温下,往过氧化氢浓溶液中投入无水氯化钙发生复分解反应,写出该可逆反应的化学方程式H2O2+CaCl2
 CaO2+2HCl.
CaO2+2HCl.②为控制低温的方式,最好将反应器放置在冰水浴中.
③测得不同温度下,过氧化钙的平均生成速率如下表所示:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| CaO2平均生成速率(×10-3mol.s-1) | 7.5 | 8.2 | 9.4 | 8.0 | 7.1 | 6.7 | 5.5 |
(2)一段时间后,再加入氨水,当调节溶液pH至9~11,才出现大量沉淀.用简要的文字解释需用氨水调节pH至9~11的原因NH3•H2O结合HCl,使反应H2O2+CaCl2
 CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.
CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.II.CaO2的热稳定性:CaO2在一定温度下能发生可逆反应,生成CaO和O2.
(3)标准生成热的定义为:在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下1mol某纯物质的热效应.已知,CaO2和CaO的标准生成热分别为a kJ•mol-1和b kJ•mol-1,请书写CaO2分解生成CaO和O2的热化学方程式2CaO2(s)
 2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.
2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.(4)一定温度下,在2L的恒容容器中进行该反应,反应过程中各物质的物质的量如下表所示:
| 时间/s | n(CaO2)/mol | n(CaO)/mol | n(O2)/mol |
| 0 | 2 | 0 | 0 |
| 1 | 1.4 | 0.6 | 0.3 |
| 2 | 1 | 1 | 0.5 |
| 3 | 1 | 1 | 0.5 |
(5)3s时,若对该容器压缩体积,其它条件不变,则当再次达到平衡时,氧气的浓度不变(填“变大”、“变小”、“不变”、“无法确定”),理由是温度不变,该反应的平衡常数K=c(CO2)=0.25mol/L不变.
(6)下列说法不能说明该反应达到平衡的是a(填字母).
a.气体的密度不再改变 b.固体质量不再改变
c.正反应速率不再改变 d.逆反应速率不再改变.
14.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6 L H2,该乙醇分子中共价键总数为4 NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
1.下列说法正确的是( )
| A. | 聚丙烯的结构简式为: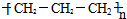 | |
| B. | 已知:正丁烷(C4H10)的二氯代物有六种同分异构体,则它的八氯代物也有六种同分异构体 | |
| C. | 四氯化碳分子的电子式为: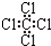 | |
| D. | 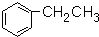 有7种吸收峰 有7种吸收峰 |
18.在一定条件下,对于密闭容器中进行的反应:2A(g)+B(g)?C(g)+D(g),下列情况可以说明这一反应已经达到平衡状态的是( )
| A. | A、B、C、D的浓度相等 | B. | A、B、C、D在密闭容器中共存 | ||
| C. | A、B、C、D的浓度不再变化 | D. | A消耗的速率与C消耗的速率相等 |
19.下列分子中每个原子最外层都达到8电子稳定结构的是( )
| A. | PCl3 | B. | H2O2 | C. | NO | D. | BF3 |