题目内容
15.在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O═HS-+OH-.下列说法正确的是( )| A. | 稀释溶液,水解平衡常数增大 | B. | 通入H2S,HS-浓度减小 | ||
| C. | 升高温度,$\frac{c(H{S}^{-})}{c({S}^{2-})}$增大 | D. | 加入NaOH固体,溶液pH减小 |
分析 根据平衡常数与温度的关系及温度、浓度对平衡的影响来分析解答;
A.平衡常数只随温度变化;
B.通入硫化氢,溶液中氢离子浓度增大;
C.水解反应是吸热反应,升温促进水解,根据平衡移动判断离子浓度变化;
D.加入NaOH固体是一种强碱,据此回答.
解答 解:A.平衡常数仅与温度有关,温度不变,则稀释时平衡常数是不变的,故A错误;
B.通入H2S,溶液中氢氧根离子浓度减小,使S2-+H2O?HS-+OH-正向移动,HS-浓度增大,故B错误;
C.水解反应是吸热反应,升温促进水解,平衡正移,c(S2-)减小,c(HS-)增大,所以$\frac{c(H{S}^{-})}{c({S}^{2-})}$增大,故C正确;
D.加入NaOH固体是一种强碱,溶液pH增大,故D错误.
故选:C.
点评 本题考查了水解平衡常数及影响水解平衡的因素,水解平衡常数和化学平衡常数一样是温度的函数,与条件无关.化学平衡移动原理同样适合水解平衡的移动,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
5.下列说法正确的是( )
| A. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| B. | M层全充满而N层为4s2的原子与核外电子排布式为1s22s22p63s23p63d64s2的原子位于同一族 | |
| C. | 如果某一基态原子3p能级上仅有2个电子,它们的自旋状态必然相同 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
6.某溶液中由水电离出来的氢离子浓度c(H+)=1×10-14mol/L,在这种溶液里可能大量共存的离子组是( )
| A. | Al3+、NH4+、SO42-、Cl- | B. | K+、Fe2+、MnO4-、Cl- | ||
| C. | NH4+、SiO32-、NO3-、K+ | D. | Na+、K+、HCO3-、Mg2+ |
10.下面的排序正确的是( )
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 晶格能由大到小:NaF>NaCl>NaBr>NaI | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 硬度由大到小:金刚石>晶体硅>碳化硅 |
20.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法正确的是( )
| A. | H2与Cl2混合后点燃与 H2 在Cl2中安静燃烧的反应速率是一样大的 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
4.有机化合物中的 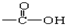 中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )
中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )
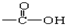 中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )
中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )| A. | HCOOH | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |


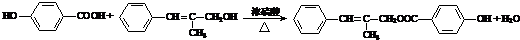

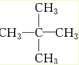 ;
; ;
;