题目内容
12.某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏高.该学生找出以下原因,其中会使溶液浓度偏高的是( )| A. | 没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 | |
| B. | 容量瓶刚用蒸馏水洗净,没有烘干 | |
| C. | 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 | |
| D. | 定容时俯视刻度线 |
分析 分析操作对溶质的物质的量n和溶液体积V的影响,依据c=$\frac{n}{V}$分析,凡是使n偏小或者使V偏大的操作都会使溶液浓度偏低,凡是使n偏达或者使V偏小的操作都会使溶液浓度偏高,以此解答该题.
解答 解:A.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中,导致溶质的物质的量偏小,则浓度偏低,故A错误;
B.容量瓶需要加热蒸馏水,无需烘干,故B错误;
C.液面略高于刻度线,导致浓度偏低,再吸出少量水使液面凹面与刻度线相切不能改变浓度,故C错误;
D.定容时俯视刻度线,体积偏小,浓度偏大,故D正确.
故选D.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,为高频考点,题目难度不大,注意掌握配制一定物质的量浓度的溶液方法,明确误差分析的方法与技巧.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
3.根据等电子原理判断,下列说法中正确的是( )
| A. | B3N3H6和苯是等电子体,B3N3H6分子中所有原子均不在同一平面上 | |
| B. | NO3-和CO32-是等电子体,均为平面正三角形结构 | |
| C. | H3O+和PCl3是等电子体,均为三角锥形 | |
| D. | CH4和NH4+是等电子体,均为正四面体形,键角均为60° |
20.下列有关物质结构的表述正确的是( )
(1)次氯酸的电子式: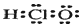
(2)Cl-的结构示意图: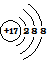
(3)二氧化硅的分子式:SiO2
(4)CO2的球棍模型示意图:
(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4-
(6)乙酸的结构简式:C2H4O2
(7)质量数为37的氯原子:1737Cl.
(1)次氯酸的电子式:
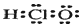
(2)Cl-的结构示意图:

(3)二氧化硅的分子式:SiO2
(4)CO2的球棍模型示意图:

(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4-
(6)乙酸的结构简式:C2H4O2
(7)质量数为37的氯原子:1737Cl.
| A. | (2)(5) | B. | (1)(6) | C. | (4)(7) | D. | (3)(4) |
17.已知有如下反应:
①2BrO3-+Cl2═Br2+2ClO3-,
②ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
③3Cl2+I2+6H2O=2HIO3+10HCl.
下列各微粒氧化能力由强到弱的顺序正确的是( )
①2BrO3-+Cl2═Br2+2ClO3-,
②ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
③3Cl2+I2+6H2O=2HIO3+10HCl.
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | Cl2>BrO3->ClO3->HIO3 | B. | ClO3->BrO3->HIO3>Cl2 | ||
| C. | BrO3->Cl2>ClO3->HIO3 | D. | BrO3->ClO3->Cl2>HIO3 |
1.下列应用或事实与胶体的性质没有关系的是( )
| A. | 用明矾净化饮用水 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 在CuSO4溶液中逐滴加入烧碱溶液出现蓝色沉淀 | |
| D. | 用手电筒照向夜空中会出现一条光柱 |
5.硫是一种生命元素,组成某些蛋白质时离不开它.SO2是硫的一种重要氧化物,为探究SO2的性质,某化学兴趣小组的同学设计了如下系列实验:
(1)为验证SO2具有还原性.将SO2气体通入溴水中,溴水褪色.写出反应的化学方程式SO2+Br2+2H2OH2SO4+2HBr.
(2)已知与SO2Na2O2的反应为进一步探究Na2O2与SO2的反应,用如图所示装置进行实验.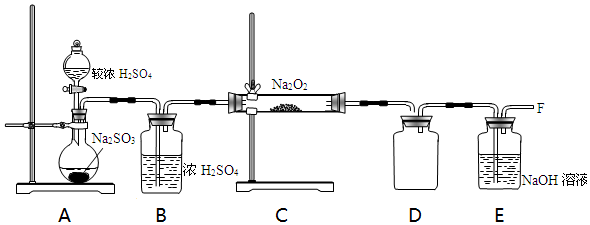
①写出A中反应的化学方程式H2SO4+Na2SO3 =Na2SO4+SO2↑+H2O.
②B装置的作用是干燥吸水.
③在F处检验到有O2生成,据此甲同学认为Na2O2与SO2发生了反应,反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2.
④乙同学认为Na2O2与SO2反应除生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下实验方案.
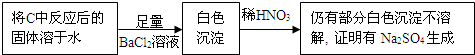
上述方案(“合理”或“不合理”)不合理,简要说明理由稀硝酸能将亚硫酸钡氧化为硫酸钡,如果反应后的固体中还残留Na2O2,它溶于水也能将亚硫酸根氧化成硫酸根.
⑤E装置中溶液呈碱性,为检验吸收液中其他阴离子,完成下列实验方案.
(1)为验证SO2具有还原性.将SO2气体通入溴水中,溴水褪色.写出反应的化学方程式SO2+Br2+2H2OH2SO4+2HBr.
(2)已知与SO2Na2O2的反应为进一步探究Na2O2与SO2的反应,用如图所示装置进行实验.

①写出A中反应的化学方程式H2SO4+Na2SO3 =Na2SO4+SO2↑+H2O.
②B装置的作用是干燥吸水.
③在F处检验到有O2生成,据此甲同学认为Na2O2与SO2发生了反应,反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2.
④乙同学认为Na2O2与SO2反应除生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下实验方案.

上述方案(“合理”或“不合理”)不合理,简要说明理由稀硝酸能将亚硫酸钡氧化为硫酸钡,如果反应后的固体中还残留Na2O2,它溶于水也能将亚硫酸根氧化成硫酸根.
⑤E装置中溶液呈碱性,为检验吸收液中其他阴离子,完成下列实验方案.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量吸收液于试管中滴加BaCl2溶液至过量 | 白色浑浊 | 吸收液中存在SO32-和SO42- |
| 取步骤I中白色沉淀于试管中,加入过量的稀盐酸 | 固体部分溶解,产生气泡 |