题目内容
12. 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)烧杯间填满碎木屑的作用是减少实验过程中的热量损失.
(2)环形玻璃搅拌棒能否用环形铜质搅拌棒代替?不能 (填“能”或“不能”),其原因是铜棒导热,使反应中放出的热量散失.
(3)为什么要用0.55mol•L-1的氢氧化钠溶液?要保证盐酸反应完全;
实验中若改用60mL 0.50mol•L-1的盐酸与50mL 0.55mol•L-1的氢氧化钠溶液进行反应,与上述实验相比,所测得的中和热相等(填“相等”或“不相等”).
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,则上述反应的热化学方程式为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1.
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得的结果偏低,请你分析结果偏低的原因可能是ABDF(填字母代号).
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天,室温较高
D.将50mL 0.55mol•L-1的氢氧化钠溶液换成了50mL 0.55mol•L-1的氨水
E.在量取盐酸时仰视读数
F.大烧杯的盖板中间小孔太大.
分析 (1)中和热测定实验成败的关键是保温工作;
(2)根据金属棒是热的良导体,易传热;
(3)根据氢氧化钠过量能保证盐酸完全反应;反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)根据物质的量与热量的关系以及热化学方程式的书写方法来解答;
(5)根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低,根据实验中用到的试剂以及实验操作知识来判断.
解答 解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(2)铜棒导热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低;
故答案为:不能;铜棒导热,使反应中放出的热量散失;
(3)用过量的氢氧化钠保证盐酸反应完全,以盐酸的量为准进行准确计算,
反应放出的热量和所用酸以及碱的量的多少有关,若用60mL 0.50mol•L-1的盐酸与50mL 0.55mol•L-1的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
故答案为:要保证盐酸反应完全;相等;
(4)在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,则热化学方程式为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1;
故答案为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1;
(5)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、将50mL 0.55mol•L-1的氢氧化钠溶液换成了50mL 0.55mol•L-1的氨水,由于氨水是弱碱,碱的电离是吸热的过程,实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,放出的热量偏大,实验测得中和热的数值偏大,故E错误;
F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,实验测得中和热的数值偏小,故F正确.
故选ABDF.
点评 本题考查中和热的测定,注意理解中和热的概念以及测定反应热的误差等问题,侧重于考查学生的实验能力和计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 加入NaOH固体 | B. | 加入CaCO3 固体 | C. | 加入食盐固体 | D. | 加入Na2SO3固体 |
| A. | 该绿色食品中不含任何化学物质 | |
| B. | 用蒸馏法可从海水中获得淡水 | |
| C. | ag碳和bg氧气完全反应,一定生成(a+b)g的二氧化碳 | |
| D. | 用规格为10mL的量筒量取6.2mL的液体 |
①天平 ②量筒 ③烧杯 ④冷凝管 ⑤温度计 ⑥试管 ⑦酒精灯.
| A. | ①②④⑤ | B. | ②③⑤ | C. | ②③④⑦ | D. | 全部 |
| A. | 1L0.1mol/L的NaF溶液中,含F-的数目小于0.1NA | |
| B. | 电解食盐水产生2gH2时转移的电子数为2NA | |
| C. | 标况下22.4L溴所含分子数目为2NA | |
| D. | 同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |

 ,C→D的反应类型为取代反应.
,C→D的反应类型为取代反应. 或
或 .
. 、
、 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).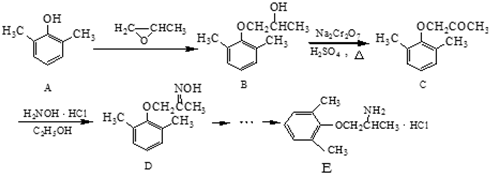
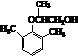 .
. .
.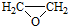 ).
).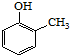 )和乙醇为原料制备
)和乙醇为原料制备 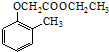 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).