题目内容
 一定条件下,将H2和N2置于密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应).如图为某时刻开始,用H2、N2和NH3表示的反应速率与时间的关系图象,请运用图象信息分析并填空:
一定条件下,将H2和N2置于密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应).如图为某时刻开始,用H2、N2和NH3表示的反应速率与时间的关系图象,请运用图象信息分析并填空:(1)反应过程中,N2和H2的消耗速率之比为
(2)反应在第30min时改变了某一外界条件,该条件是
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据相等的时间段内氮气和氢气的浓度的变化量之比等于N2和H2的消耗速率之比来回答判断;
(2)反应在第30min时正方应速率突然减小而逆反应速率突然增大,根据影响化学反应速率的因素:浓度知识来回答.
(2)反应在第30min时正方应速率突然减小而逆反应速率突然增大,根据影响化学反应速率的因素:浓度知识来回答.
解答:
解:(1)在10~30min的时间间隔段内,氮气和氢气的浓度的变化量之比等于0:05:0.15=1:3,所以N2和H2的消耗速率之比为1:3,故答案为:1:3;
(2)由图象可知第30min时,正方应速率突然减小而逆反应速率突然增大,所以只能是降低反应物浓度同时增大生成物浓度,
故答案为:降低反应物浓度同时增大生成物浓度;由图象可知第30min时,正方应速率突然减小而逆反应速率突然增大,所以只能是降低反应物浓度同时增大生成物浓度.
(2)由图象可知第30min时,正方应速率突然减小而逆反应速率突然增大,所以只能是降低反应物浓度同时增大生成物浓度,
故答案为:降低反应物浓度同时增大生成物浓度;由图象可知第30min时,正方应速率突然减小而逆反应速率突然增大,所以只能是降低反应物浓度同时增大生成物浓度.
点评:化学反应速率之比等于单位时间内物质的浓度的变化量之比,根据影响化学反应速率的因素:浓度知识来回答判断即可.

练习册系列答案
相关题目
下列做法与化学反应速率无关的是( )
| A、延长反应时间 |
| B、使用合适的催化剂 |
| C、增加反应物的浓度 |
| D、改变反应的温度 |
乙烯是石油化工重要的原料之一,列举乙烯在化学工业的一种用途 .实验室制取乙烯用到的浓硫酸作 剂和 剂.乙烯可转化成乙醛,乙醛分子结构中的“ ”称为 基,实验室检验这一官能团通常用 (填一种试剂的名称).
”称为 基,实验室检验这一官能团通常用 (填一种试剂的名称).
 ”称为
”称为短周期主族元素M、N、X、Y、Z的原子序数依次增大.又知M与X同主族,N原子的最外层电子数是电子层数的3倍,M原子的原子半径小于N原子的原子半径,Z的原子半径在同周期元素中是最小的,Y原子的电子层数与最外层电子数相等.下列叙述正确的是( )
| A、单质的还原性:Y>X |
| B、元素M与N只能形成一种共价化合物 |
| C、通常状况下,元素Z的单质不能与元素M的氧化物反应 |
| D、元素X、Y、Z的最高价氧化物对应的水化物彼此间均可发生反应 |



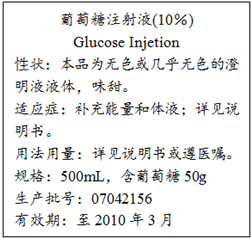 如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):
如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):