题目内容
烟气中NOx是NO和NO2的混合物
(1)根据废气排放标准,1m3烟气最高允许含400mg NOx.若NOx中NO质量分数为0.54,则100m3烟气中最高允许含NOx L(标准状况),最高允许NOx分子数目为 .
(2)如果用溶质质量分数为0.106的Na2CO3水溶液(密度1.1g/ml)作为NOx吸收剂,该碳酸钠溶液物质的量为 mol/L.
(3)已知:NO+NO2+Na2CO3═2NaNO3+CO2
2NO2+Na2CO3═NaNO2+NaNO3+CO2
NO不能直接被Na2CO3水溶液吸收
1000m3(1)中所述烟气尽可能被(2)中所述Na2CO3水溶液吸收,至少需要 LNa2CO3水溶液(保留2位小数),烟气中NOx (填“能”或“不能”)被除尽.
(1)根据废气排放标准,1m3烟气最高允许含400mg NOx.若NOx中NO质量分数为0.54,则100m3烟气中最高允许含NOx
(2)如果用溶质质量分数为0.106的Na2CO3水溶液(密度1.1g/ml)作为NOx吸收剂,该碳酸钠溶液物质的量为
(3)已知:NO+NO2+Na2CO3═2NaNO3+CO2
2NO2+Na2CO3═NaNO2+NaNO3+CO2
NO不能直接被Na2CO3水溶液吸收
1000m3(1)中所述烟气尽可能被(2)中所述Na2CO3水溶液吸收,至少需要
考点:氮的氧化物的性质及其对环境的影响,化学方程式的有关计算
专题:
分析:(1)根据NO的质量分数计算NO的质量,再计算出二氧化氮的质量,然后根据n=
计算NO、二氧化氮的物质的量,根V=nVm计算最高允许含NOx的体积;根据N=nNA计算出最高允许含有的气体分子数;
(2)根据c=
计算碳酸钠溶液物质的量浓度;
(3)根据(1)的计算结果推断出1000m3(1)中所述烟气高徒的NO、二氧化氮的物质的量,再根据反应方程式计算出需要碳酸钠溶液的体积,并根据计算结果判断NO是否完全反应,从而得出NOx是否被除尽.
| m |
| M |
(2)根据c=
| 1000ρω |
| M |
(3)根据(1)的计算结果推断出1000m3(1)中所述烟气高徒的NO、二氧化氮的物质的量,再根据反应方程式计算出需要碳酸钠溶液的体积,并根据计算结果判断NO是否完全反应,从而得出NOx是否被除尽.
解答:
解:(1)1m3烟气最高允许含400mg NOx,则100m3烟气中最多允许NOx的质量为:400mg×
=40g,
40gNOx中有NO的物质的量为:n(NO)=
=0.72mol,含有NO2的物质的量为:n(NO2)=
=0.4mol,
最多允许的气体的物质的量为:0.72mL+0.4mol=1.12mol,标况下该气体的体积为:22.4L/mol×1.12mol=25.088L,
100m3烟气中最高允许含NOx分子数为:N=nNA=1.12NA,
故答案为:25.088;1.12NA;
(2)该碳酸钠溶液物质的量浓度为:c=
mol/L=1.1mol/L,
故答案为:1.1;
(3)1000m3(1)中所述烟气中含有NO的物质的量为:0.72mol×
=7.2mol,含有NO2的物质的量为:n(NO2)=0.4mol×
=4mol,
根据反应方程式可知,由于NO的物质的量大于二氧化氮,所以NOx不能被除尽;
根据反应NO+NO2+Na2CO3═2NaNO3+CO2可知,除去氮的氧化物需要消耗碳酸钠的物质的量为:n(NaNO3)=n(NO2)=4mol,
需要1.1mol/L的碳酸钠溶液的体积为:
≈3.64L,
故答案为:3.64L;不能.
| 100m3 |
| 1m3 |
40gNOx中有NO的物质的量为:n(NO)=
| 40g×0.54 |
| 30g/mol |
| 40g(1-0.54) |
| 46g/mol |
最多允许的气体的物质的量为:0.72mL+0.4mol=1.12mol,标况下该气体的体积为:22.4L/mol×1.12mol=25.088L,
100m3烟气中最高允许含NOx分子数为:N=nNA=1.12NA,
故答案为:25.088;1.12NA;
(2)该碳酸钠溶液物质的量浓度为:c=
| 1000×1.1×0.106 |
| 106 |
故答案为:1.1;
(3)1000m3(1)中所述烟气中含有NO的物质的量为:0.72mol×
| 1000m3 |
| 100m3 |
| 1000m3 |
| 100m3 |
根据反应方程式可知,由于NO的物质的量大于二氧化氮,所以NOx不能被除尽;
根据反应NO+NO2+Na2CO3═2NaNO3+CO2可知,除去氮的氧化物需要消耗碳酸钠的物质的量为:n(NaNO3)=n(NO2)=4mol,
需要1.1mol/L的碳酸钠溶液的体积为:
| 4mol |
| 1.1mol/L |
故答案为:3.64L;不能.
点评:本题考查氮的氧化物的性质、物质的量浓度计算、物质含量的有关计算等知识,题目难度中等,明确题干信息为解答关键,试题涉及的计算量稍大,充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中正确的是( )
| A、摩尔是用于计量微观粒子集体的物理量 |
| B、CO2的摩尔质量为44g |
| C、0.5mol水中约含6.02×1023个H |
| D、标准状况下1 mol任何物质体积均为22.4L |
常温下,对于下列电解质溶液的说法正确的是( )
| A、pH=1的溶液中,Fe3+、I-、NO3-、K+可以大量共存 |
| B、用过量的NaOH溶液吸收SO2的离子方程式:SO2+OH-=HSO3- |
| C、在c(SO32-)=0.1 mol.L-1的溶液中,Na+、C1-、H+、Ca2+可以大量共存 |
| D、向澄清石灰水中通入氯气,反应的离子方程式:2OH-+Cl2=C1-+C1O-+H2O |
制备乙酸乙酯的一条合成路线为:下列说法错误的是( )
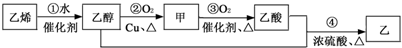

| A、乙的结构简式为CH3COOCH2CH3 | |||
| B、乙醇与CH3OCH3(二甲醚)互为同分异构体 | |||
| C、反应①属于加成反应 | |||
D、反应②的化学方程式为2CH3CH2OH+O2
|
两名日本科学家与一名美国科学家利用钯作催化剂,将有机物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而获2010年诺贝尔化学奖.下列说法正确的是( )
| A、有机物中一定含有碳和氢两种元素 |
| B、一定条件下,催化剂能提高反应物的转化率 |
| C、将有机物进行“缝合”可以不遵循原子守恒定律 |
| D、将有机物进行“裁剪”需要破坏旧的化学键 |
下列物质的分子正负电荷重心不相重合的是( )
| A、C2H2 |
| B、CO2 |
| C、NH3 |
| D、BF3 |
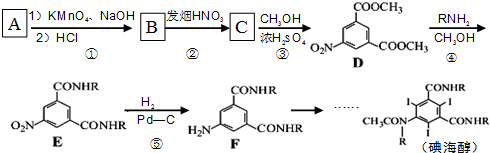
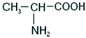 属于α-氨基酸);
属于α-氨基酸);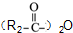 →
→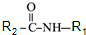 +R2COOH
+R2COOH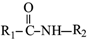 +NaOH→R1COONa+R2NH2
+NaOH→R1COONa+R2NH2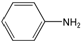 呈弱碱性,易被氧化
呈弱碱性,易被氧化 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 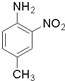 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
 ,所需溴代烃的结构简式为
,所需溴代烃的结构简式为