题目内容
 现有浓度均为0.1mol?L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、
现有浓度均为0.1mol?L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是(填序号)
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是
(4)已知t℃时,KW=1×10-13,则t℃(填“>”、“<”或“=”)
(5)同体积、同物质的量浓度的①硫酸和②醋酸溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小关系为①
(6)同体积、相同pH的①硫酸和②醋酸溶液中分别投入足量且等质量的锌,开始放H2的速率:①
(7)已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是
A.a点表示溶液中c(CH3COO-)约为10-3 mol/L
B.b点表示的溶液中c(Na+)>c(CH3COO-)
C.c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
E.b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)=c(A-)+c(OH-)
考点:离子浓度大小的比较,化学反应速率的影响因素,难溶电解质的溶解平衡及沉淀转化的本质,酸碱混合时的定性判断及有关ph的计算
专题:
分析:(1)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大其抑制水电离程度越大;
(2)盐为强电解质,在水溶液里完全电离,一水合氨是弱电解质,在水溶液里部分电离,醋酸根离子促进铵根离子水解、氢离子抑制铵根离子水解;
(3)将③和④按体积比1:2混合后,溶液中的溶质是等物质的量浓度的NaCl、NH4Cl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度,所以溶液呈碱性,再结合物料守恒判断;
(4)水的电离是吸热反应,升高温度促进水电离,在水的离子积常数增大;根据混合溶液的pH计算两种溶液的体积之比;
(5)物质的量相等的硫酸和醋酸,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小与酸的元数成正比;
(6)pH相等的醋酸和硫酸溶液中,生成氢气的速率与氢离子浓度成正比,氢离子浓度相等则其反应速率相等;反应过程中,弱电解质电离导致弱电解质溶液中氢离子浓度大于强电解质溶液,所以弱电解质溶液反应速率大于强电解质溶液;
(7)A.酸能抑制水的电离,再根据弱电解质的性质分析溶液中醋酸根离子的浓度.
B.从溶液电中性的角度分析;
C、根据醋酸和氢氧化钠生成盐的类型判断恰好反应时溶液的酸碱性,从而确定该选项是否正确.
D、电离平衡常数只与温度有关,与其它任何条件都无关;
E、根据电荷守恒解答.
(2)盐为强电解质,在水溶液里完全电离,一水合氨是弱电解质,在水溶液里部分电离,醋酸根离子促进铵根离子水解、氢离子抑制铵根离子水解;
(3)将③和④按体积比1:2混合后,溶液中的溶质是等物质的量浓度的NaCl、NH4Cl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度,所以溶液呈碱性,再结合物料守恒判断;
(4)水的电离是吸热反应,升高温度促进水电离,在水的离子积常数增大;根据混合溶液的pH计算两种溶液的体积之比;
(5)物质的量相等的硫酸和醋酸,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小与酸的元数成正比;
(6)pH相等的醋酸和硫酸溶液中,生成氢气的速率与氢离子浓度成正比,氢离子浓度相等则其反应速率相等;反应过程中,弱电解质电离导致弱电解质溶液中氢离子浓度大于强电解质溶液,所以弱电解质溶液反应速率大于强电解质溶液;
(7)A.酸能抑制水的电离,再根据弱电解质的性质分析溶液中醋酸根离子的浓度.
B.从溶液电中性的角度分析;
C、根据醋酸和氢氧化钠生成盐的类型判断恰好反应时溶液的酸碱性,从而确定该选项是否正确.
D、电离平衡常数只与温度有关,与其它任何条件都无关;
E、根据电荷守恒解答.
解答:
解:(1)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大其抑制水电离程度越大,0.1mol/L的①硫酸、②醋酸、③氢氧化钠、④氯化铵中,硫酸中氢离子浓度为0.2mol/L、醋酸中氢离子浓度小于0.1mol/L、氢氧化钠溶液中氢氧根离子浓度为0.1mol/L,氯化铵促进水电离,所以①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,故答案为:④②③①;
(2)氯化铵、醋酸铵、硫酸氢铵属于强碱,在水溶液里完全电离,一水合氨是弱电解质,在水溶液里部分电离,醋酸根离子促进铵根离子水解、氢离子抑制铵根离子水解,所以铵根离子浓度大小顺序是⑥④⑤⑦,故答案为:⑥④⑤⑦;
(3)将③和④按体积比1:2混合后,溶液中的溶质是等物质的量浓度的NaCl、NH4Cl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度,所以溶液呈碱性,一水合氨电离导致溶液中c(NH4+)>c(Na+),结合物料守恒、溶液酸碱性知,溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),
故答案为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)水的电离是吸热反应,升高温度促进水电离,在水的离子积常数增大,t℃时,KW=1×10-13,则t℃>25℃,t℃时将pH=11的NaOH溶液中c(OH-)=
mol/L=0.01mol/L,
pH=1的H2SO4溶液中c(H+)=0.1mol/L,混合溶液中c(H+)=
mol/L=0.01mol/L,则a:b=9:2,
故答案为:>;9:2;
(5)物质的量相等的硫酸和醋酸,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小与酸的元数成正比,硫酸是二元酸、醋酸是一元酸,所以所需NaOH体积大小关系为①>②,故答案为:大于;
(6)pH相等的醋酸和硫酸溶液中,生成氢气的速率与氢离子浓度成正比,氢离子浓度相等则其反应速率相等,所以pH相等的醋酸和硫酸中开始反应速率相等;
随着反应的进行,硫酸中氢离子浓度减少,醋酸电离出氢离子导致醋酸中氢离子浓度大于硫酸,则反应速率为①<②;
硫酸的反应速率小于醋酸,所以反应时间①>②,
故答案为:相等;小于;小于;
(7)A.a点是c(H+)=10-3mol/L,由于醋酸为弱酸,酸能抑制水的电离,醋酸的电离远远大于水的电离,所以溶液中氢离子浓度近似等于醋酸根离子浓度,故A正确;
B.溶液满足c(Na+)+c(H+)=c(OH-)+c(CH3COO-),b点时,c(H+)>c(OH-),则有c(CH3COO-)>c(Na+),故B错误;
C、醋酸和氢氧化钠反应生成醋酸钠,醋酸钠是强碱弱酸盐其水溶液呈碱性,当酸碱恰好反应时溶液应该呈碱性,但C点溶液呈中性,说明酸过量,故C错误;
D、b、d两点溶液的温度相同,所以b、d点表示的溶液中
等于K,故D错误;
E、根据电荷守恒,b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)=c(A-)+c(OH-),故E正确;
故选AE.
(2)氯化铵、醋酸铵、硫酸氢铵属于强碱,在水溶液里完全电离,一水合氨是弱电解质,在水溶液里部分电离,醋酸根离子促进铵根离子水解、氢离子抑制铵根离子水解,所以铵根离子浓度大小顺序是⑥④⑤⑦,故答案为:⑥④⑤⑦;
(3)将③和④按体积比1:2混合后,溶液中的溶质是等物质的量浓度的NaCl、NH4Cl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度,所以溶液呈碱性,一水合氨电离导致溶液中c(NH4+)>c(Na+),结合物料守恒、溶液酸碱性知,溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),
故答案为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)水的电离是吸热反应,升高温度促进水电离,在水的离子积常数增大,t℃时,KW=1×10-13,则t℃>25℃,t℃时将pH=11的NaOH溶液中c(OH-)=
| 10-13 |
| 10-11 |
pH=1的H2SO4溶液中c(H+)=0.1mol/L,混合溶液中c(H+)=
| 0.1b-0.01a |
| a+b |
故答案为:>;9:2;
(5)物质的量相等的硫酸和醋酸,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小与酸的元数成正比,硫酸是二元酸、醋酸是一元酸,所以所需NaOH体积大小关系为①>②,故答案为:大于;
(6)pH相等的醋酸和硫酸溶液中,生成氢气的速率与氢离子浓度成正比,氢离子浓度相等则其反应速率相等,所以pH相等的醋酸和硫酸中开始反应速率相等;
随着反应的进行,硫酸中氢离子浓度减少,醋酸电离出氢离子导致醋酸中氢离子浓度大于硫酸,则反应速率为①<②;
硫酸的反应速率小于醋酸,所以反应时间①>②,
故答案为:相等;小于;小于;
(7)A.a点是c(H+)=10-3mol/L,由于醋酸为弱酸,酸能抑制水的电离,醋酸的电离远远大于水的电离,所以溶液中氢离子浓度近似等于醋酸根离子浓度,故A正确;
B.溶液满足c(Na+)+c(H+)=c(OH-)+c(CH3COO-),b点时,c(H+)>c(OH-),则有c(CH3COO-)>c(Na+),故B错误;
C、醋酸和氢氧化钠反应生成醋酸钠,醋酸钠是强碱弱酸盐其水溶液呈碱性,当酸碱恰好反应时溶液应该呈碱性,但C点溶液呈中性,说明酸过量,故C错误;
D、b、d两点溶液的温度相同,所以b、d点表示的溶液中
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
E、根据电荷守恒,b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)=c(A-)+c(OH-),故E正确;
故选AE.
点评:本题考查较综合,涉及离子浓度大小的比较、弱电解质的电离、酸碱混合溶液定性判断等知识点,根据弱电解质的电离特点、盐类水解特点结合溶液酸碱性来确定离子浓度大小,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列有机物的一氯代物种类数的比较,正确的是( )


| A、②>③=①>④ |
| B、②>③>①>④ |
| C、①=②=③=④ |
| D、③=④>①=② |
下列物质必须隔绝空气保存的是( )
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3 ⑥NaCl.
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3 ⑥NaCl.
| A、①② | B、②③④⑤ |
| C、①②③④ | D、①②③④⑤ |
下列有关物质性质或应用的说法正确的是( )
A、钠的金属性比钾强,工业上用钠制取钾(Na+KCl
| ||||
| B、利用Al2O3制作的坩埚,可用于熔融烧碱 | ||||
| C、氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | ||||
| D、制水泥和玻璃都用石灰石作原料 |
常温下,以下4种溶液pH最小的是( )
| A、0.01mol?L-1醋酸溶液 |
| B、0.02mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| C、0.03mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| D、pH=2的盐酸与pH=12NaOH溶液等体积混合液 |
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,11.2 L NO和11.2 L O2混合后气体的分子总数为NA |
| B、常温常压下,44 g 由N2O与CO2组成的混合气体含有的分子数目为NA |
| C、0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA |
| D、标准状况下,2.24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
下列溶液中,相关微粒的浓度关系正确的是( )
| A、MgSO4溶液:c(Mg2+)+c(H+)=c (SO42-)+c(OH-) |
| B、将0.2mol?L-1CH3COOH溶液与0.1mo1?L-1NaOH溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| C、将pH=2的盐酸与0.01 mo1?L-1氨水等体积混合:c(NH4+)=c (Cl-) |
| D、由AgCl和AgI固体混合物与水形成的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
化学与环境、生活、材料密切相关.下列说法正确的是( )
| A、“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物有关 |
| B、漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 |
| C、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作消毒剂和净水剂 |
| D、在食品袋中放入盛有硅胶、生石灰的透气小袋,可防止食物受潮 |
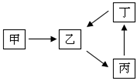 甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.