题目内容
已知两种相邻周期、相邻主族的短周期非金属元素X、Y,其最高价氧化物的水化物均为强酸.根据如图转化关系(反应条件及部分产物已略去),回答下列问题:

(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于 (填“离子化合物”或“共价化合物”).
②反应I的化学方程式为 .
③将1.92g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12L(标准状况),则反应消耗的D的物质的量为 mol.
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34g?mol-1,则:
①将铜粉与D的浓溶液反应所得溶液加热蒸干,得到的白色固体物质为 (填化学式).
②将少量Na2Y溶液滴加到次氯酸钠溶液中发生反应,无沉淀生成,请写出该反应的离子反应方程式 .在该反应中若有74.5g NaClO被还原,则转移电子的物质的量为 mol.

(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于
②反应I的化学方程式为
③将1.92g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12L(标准状况),则反应消耗的D的物质的量为
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34g?mol-1,则:
①将铜粉与D的浓溶液反应所得溶液加热蒸干,得到的白色固体物质为
②将少量Na2Y溶液滴加到次氯酸钠溶液中发生反应,无沉淀生成,请写出该反应的离子反应方程式
考点:无机物的推断
专题:推断题
分析:两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸,故X、Y两元素一种为N元素,另一种为S元素.
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,故X为N元素,A为NH3,由A与E反应生成B,B与E反应生成C,考虑E为O2,B为NO,C为NO2,由Cu+D→B,C+F→D可知,D为硝酸,F为H2O,验证符合转化关系,则:
①由上述分析可知,F为H2O;
②反应I是氨气催化氧化生成NO与水;
③1.92g铜的物质的量为0.03mol,生成Cu(NO3)2的物质的量为0.03mol,生成的气体的物质的量为0.05mol,根据氮元素守恒计算;
(2)Y元素为S元素,若A、B、C、D均为含Y元素的化合物,由Cu+D→B,考虑D为H2SO4,B为SO2,A的摩尔质量为34g?mol-1,则A为H2S,可以推知E为O2,C为SO3,F为H2O,验证符合转化关系,则:
①将反应IV是铜与硫酸反应生成硫酸铜、二氧化硫与水,所得的溶液是硫酸铜溶液,加热蒸干得到的物质是CuSO4;
②化合物Na2S和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,生成硫酸钠、氯化钠与水,结合化合价的变化解答.
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,故X为N元素,A为NH3,由A与E反应生成B,B与E反应生成C,考虑E为O2,B为NO,C为NO2,由Cu+D→B,C+F→D可知,D为硝酸,F为H2O,验证符合转化关系,则:
①由上述分析可知,F为H2O;
②反应I是氨气催化氧化生成NO与水;
③1.92g铜的物质的量为0.03mol,生成Cu(NO3)2的物质的量为0.03mol,生成的气体的物质的量为0.05mol,根据氮元素守恒计算;
(2)Y元素为S元素,若A、B、C、D均为含Y元素的化合物,由Cu+D→B,考虑D为H2SO4,B为SO2,A的摩尔质量为34g?mol-1,则A为H2S,可以推知E为O2,C为SO3,F为H2O,验证符合转化关系,则:
①将反应IV是铜与硫酸反应生成硫酸铜、二氧化硫与水,所得的溶液是硫酸铜溶液,加热蒸干得到的物质是CuSO4;
②化合物Na2S和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,生成硫酸钠、氯化钠与水,结合化合价的变化解答.
解答:
解:两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸,故X、Y两元素一种为N元素,另一种为S元素.
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,故X为N元素,A为NH3,由A与E反应生成B,B与E反应生成C,考虑E为O2,B为NO,C为NO2,由Cu+D→B,C+F→D可知,D为硝酸,F为H2O,验证符合转化关系,则:
①由上述分析可知,F为H2O,属于共价化合物,故答案为:共价化合物;
②反应I是氨气催化氧化生成NO与水,反应方程式为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
③1.92g铜的物质的量为0.03mol,生成Cu(NO3)2的物质的量为0.03mol,生成的气体的物质的量为0.05mol,根据氮元素守恒,消耗的硝酸的物质的量为0.03mol×2+0.05mol=0.11mol,故答案为:0.11mol;
(2)Y元素为S元素,若A、B、C、D均为含Y元素的化合物,由Cu+D→B,考虑D为H2SO4,B为SO2,A的摩尔质量为34g?mol-1,则A为H2S,可以推知E为O2,C为SO3,F为H2O,验证符合转化关系,则:
①将反应IV是铜与硫酸反应生成硫酸铜、二氧化硫与水,所得的溶液是硫酸铜溶液,加热蒸干得到的物质是CuSO4,故答案为:CuSO4;
②化合物Na2S和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,生成硫酸钠、氯化钠与水,该反应的离子反应方程式:S2-+4ClO-=SO42-+4Cl-;
74.5g NaClO的物质的量为1mol,NaClO的还原产物为Cl-,则转移的电子的物质的量为2mol,故答案为:S2-+4ClO-=SO42-+4Cl-;2
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,故X为N元素,A为NH3,由A与E反应生成B,B与E反应生成C,考虑E为O2,B为NO,C为NO2,由Cu+D→B,C+F→D可知,D为硝酸,F为H2O,验证符合转化关系,则:
①由上述分析可知,F为H2O,属于共价化合物,故答案为:共价化合物;
②反应I是氨气催化氧化生成NO与水,反应方程式为:4NH3+5O2
| ||
| 催化剂 |
| ||
| 催化剂 |
③1.92g铜的物质的量为0.03mol,生成Cu(NO3)2的物质的量为0.03mol,生成的气体的物质的量为0.05mol,根据氮元素守恒,消耗的硝酸的物质的量为0.03mol×2+0.05mol=0.11mol,故答案为:0.11mol;
(2)Y元素为S元素,若A、B、C、D均为含Y元素的化合物,由Cu+D→B,考虑D为H2SO4,B为SO2,A的摩尔质量为34g?mol-1,则A为H2S,可以推知E为O2,C为SO3,F为H2O,验证符合转化关系,则:
①将反应IV是铜与硫酸反应生成硫酸铜、二氧化硫与水,所得的溶液是硫酸铜溶液,加热蒸干得到的物质是CuSO4,故答案为:CuSO4;
②化合物Na2S和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,生成硫酸钠、氯化钠与水,该反应的离子反应方程式:S2-+4ClO-=SO42-+4Cl-;
74.5g NaClO的物质的量为1mol,NaClO的还原产物为Cl-,则转移的电子的物质的量为2mol,故答案为:S2-+4ClO-=SO42-+4Cl-;2
点评:本题考查了无机物推断,为高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及N、S等元素单质及其化合物之间的相互转化,X、Y两元素最高价氧化物的水化物均为强酸及再周期表中的位置为解题突破口,推断出X、Y元素后,根据题目信息结合转化关系进行推断,需要学生熟练掌握元素化合物性质.

练习册系列答案
相关题目
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
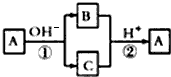

| A、X元素一定为非金属元素 |
| B、X元素可能为Al |
| C、反应①和②互为可逆反应 |
| D、反应①和②可能为氧化还原反应 |
 使用锂离子电池为动力汽车,可减少有害气体的排放.锰酸锂离子蓄电池的反应式为:Li1-xMnO4+LixC
使用锂离子电池为动力汽车,可减少有害气体的排放.锰酸锂离子蓄电池的反应式为:Li1-xMnO4+LixC| 放电 |
| 充电 |
| A、充电时电池内部Li+向正极移动 |
| B、放电过程中,电能转化为化学能 |
| C、放电时电池的正极反应式为:Li1-xMnO4+xe-+xLi+=LiMnO4 |
| D、充电时电池的正极应与外接电源的负极相连 |
从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,不正确的是( )


| A、实验室在蒸发皿中灼烧干海带,并且用玻璃搅拌 |
| B、含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应 |
| C、在碘水中加入几滴淀粉溶液,溶液变蓝色 |
| D、碘水中加入CCl4得到I2的CCl4的溶液,该操作为“萃取” |
常温下,以下4种溶液pH最小的是( )
| A、0.01mol?L-1醋酸溶液 |
| B、0.02mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| C、0.03mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| D、pH=2的盐酸与pH=12NaOH溶液等体积混合液 |

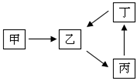 甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.


