题目内容
15.在一定条件下发生下列反应,其中属于盐类水解反应的是( )| A. | NH4++2H2O?NH3•H2O+H3O+ | B. | HCO3-+H2O?H3O++CO32- | ||
| C. | HS-+H+═H2S | D. | Cl2+H2O?H++Cl-+HClO |
分析 在盐中有弱酸根离子或弱碱离子时,与水电离产生的氢离子或氢氧根离子结合生成弱电解质,则发生的反应为盐类的水解反应.
解答 解:A.铵根离子为弱碱离子,结合水电离产生的OH-,水解反应为NH4++2H2O?NH3•H2O+H3O+,故A正确;
B.碳酸氢根离子水解生成碳酸,而HCO3-+H2O?H3O++CO32-为电离反应,故B错误;
C.HS-+H+═H2S中没有水参加反应,则不属于水解反应,HS-水解生成H2S和OH-,故C错误;
D.氯气为单质,Cl2+H2O?H++Cl-+HClO不属于水解反应,故D错误;
故选A.
点评 本题考查水解的原理,明确盐中的构成及“有弱才水解的规律”即可解答,注意离子结合水电离产生的氢离子或氢氧根离子结合生成弱电解质是解答的关键,题目难度不大.

练习册系列答案
相关题目
20.菜谱中记载:河虾不宜与西红柿同食.主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷.下列说法不正确的是( )
| A. | 五价砷在维生素C作用下发生了还原反应 | |
| B. | “两者同食”发生的反应中维生素C作还原剂 | |
| C. | 河虾中含有的五价砷,没有毒性 | |
| D. | 毒药砒霜是含砷的氧化物,可以推测砒霜中所含的砷元素化合价为+5 |

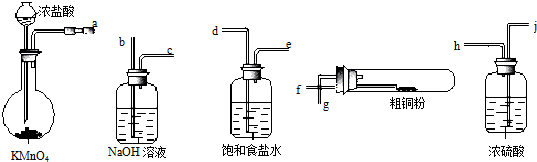
 .
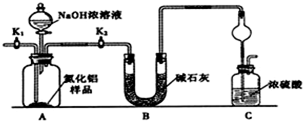
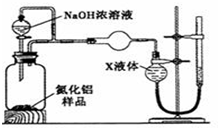
.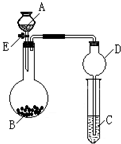 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: