题目内容
燃煤烟气中含有大量的氮氧化合物(NOx)、二氧化硫和二氧化碳等,不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.
(1)脱硝:选择性催化还原法的脱硝原理是在催化剂存在下,通入甲烷使氮氧化合物(NOx)转化为无害气体,发生如下反应:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 .
(2)脱硫:①石灰石-石膏湿法烟气脱硫的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的
空气反应生成石膏(CaSO4?2H2O).某电厂用煤400吨(煤中含硫质量分数为2.5%),若燃烧时煤中的硫全
部转化成二氧化硫,用石膏湿法烟气脱硫中有96%的硫转化为石膏,则可生产石膏 吨.
②新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示:若2molZnFe2Ox与足量SO2可生成1.0molS,

则x= .
(3)脱碳:从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
①取五份等体体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”).
②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图2所示.若在上述平衡体系中再充0.5mol CO2和1.5mol H2O(g) (保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)
③直接甲醇燃料电池结构如图3所示.其工作时负极电极反应式可表示为 .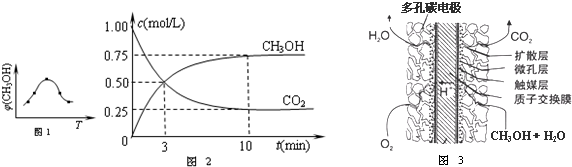
(1)脱硝:选择性催化还原法的脱硝原理是在催化剂存在下,通入甲烷使氮氧化合物(NOx)转化为无害气体,发生如下反应:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱硫:①石灰石-石膏湿法烟气脱硫的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的
空气反应生成石膏(CaSO4?2H2O).某电厂用煤400吨(煤中含硫质量分数为2.5%),若燃烧时煤中的硫全
部转化成二氧化硫,用石膏湿法烟气脱硫中有96%的硫转化为石膏,则可生产石膏
②新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示:若2molZnFe2Ox与足量SO2可生成1.0molS,

则x=
(3)脱碳:从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
①取五份等体体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的△H3
②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图2所示.若在上述平衡体系中再充0.5mol CO2和1.5mol H2O(g) (保持温度不变),则此平衡将
③直接甲醇燃料电池结构如图3所示.其工作时负极电极反应式可表示为

考点:热化学方程式,化学方程式的有关计算,化学电源新型电池,活化能及其对化学反应速率的影响
专题:基本概念与基本理论
分析:(1)根据盖斯定律可写出热化学方程式;
(2)①根据关系式S~SO2~CaSO4?2H2O来计算;
②依据氧化还原反应的电子守恒和化合物中的元素化合价代数为0计算得到;
(3)①由图可知,到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
②依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算平衡常数,再充入物质,结合浓度商计算和平衡常数比较分析判断分析进行方向;
③图示分析判断,电解质溶液为酸性溶液,甲醇燃料在负极失电子发生氧化反应生成二氧化碳,结合电荷守恒书写电极反应.
(2)①根据关系式S~SO2~CaSO4?2H2O来计算;
②依据氧化还原反应的电子守恒和化合物中的元素化合价代数为0计算得到;
(3)①由图可知,到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
②依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算平衡常数,再充入物质,结合浓度商计算和平衡常数比较分析判断分析进行方向;
③图示分析判断,电解质溶液为酸性溶液,甲醇燃料在负极失电子发生氧化反应生成二氧化碳,结合电荷守恒书写电极反应.
解答:
解:(1)将反应CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol和CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol相加再约去公约数即可得反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),其反应热△H=
=-867kJ/mol,热反应方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol;
(2)①S~SO2 ~CaSO4?2H2O
32 172
400t×2.5%×96% m
,解得m=51.6t,
故答案为:51.6;
②新型纳米材料ZnFe2Ox可由化合物ZnFe2O4经高温还原制得,若2mol ZnFe2O x与SO2反应可生成1molS,则ZnFe2O x被还原为ZnFe2O4,令中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=1mol×4,解得,a=2,利用化合价代数和为,2+2×2=2x,解得x=3;故答案为:3;
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,故答案为:<;
②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图1所示,平衡浓度c(CO2)=0.25mol/L,c(CH3OH)=0.75mol/L,则
CO2 (g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
平衡常数K=
=5.3
若在上述平衡体系中再充0.5mol CO2和1.5mol 水蒸气(保持温度不变),浓度商Q=
=5.3=K,则平衡不移动;
故答案为:不;
③直接甲醇燃料电池结构如图2所示,图示分析判断,电解质溶液为酸性溶液,甲醇燃料在负极失电子发生氧化反应生成二氧化碳,结合电荷守恒书写负极电极反应为:CH3OH-6e-+H2O=6H++CO2;
故答案为:CH3OH-6e-+H2O=6H++CO2.
| △H1+△H2 |
| 2 |
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol;
(2)①S~SO2 ~CaSO4?2H2O
32 172
400t×2.5%×96% m
| 32 |
| 400t×2.5%×96% |
故答案为:51.6;
②新型纳米材料ZnFe2Ox可由化合物ZnFe2O4经高温还原制得,若2mol ZnFe2O x与SO2反应可生成1molS,则ZnFe2O x被还原为ZnFe2O4,令中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=1mol×4,解得,a=2,利用化合价代数和为,2+2×2=2x,解得x=3;故答案为:3;
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,故答案为:<;
②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图1所示,平衡浓度c(CO2)=0.25mol/L,c(CH3OH)=0.75mol/L,则
CO2 (g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
平衡常数K=
| 0.75×0.75 |
| 0.25×0.753 |
若在上述平衡体系中再充0.5mol CO2和1.5mol 水蒸气(保持温度不变),浓度商Q=
| 0.75×(0.75+1.5) |
| (0.25+0.25)×0.753 |
故答案为:不;
③直接甲醇燃料电池结构如图2所示,图示分析判断,电解质溶液为酸性溶液,甲醇燃料在负极失电子发生氧化反应生成二氧化碳,结合电荷守恒书写负极电极反应为:CH3OH-6e-+H2O=6H++CO2;
故答案为:CH3OH-6e-+H2O=6H++CO2.
点评:本题主要考查了热化学方程式、转化率、化学平衡常数、化学平衡状态的判断、影响平衡移动的因素、原电池原理分析应用,考点较多,有一定的综合性,掌握基础是关键,中等难度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
化学与社会、科学、技术、环境密切相关.下列说法不正确的是( )
| A、预防H7N9流感病毒的措施之一是高温消毒餐具等生活用品 |
| B、《添加剂标准》中儿童膨化食品拟禁含铝添加剂,铝对人体有害 |
| C、绿色化学的核心是应用化学原理对环境污染进行治理 |
| D、明矾、硫酸铁等在水中因水解生成胶体粒子,都可以作净水剂 |
将含有0.400mol Cu(NO3)2和0.400mol KCl的水溶液1L,用惰性电极电解一段时间后,在一个电极上析出0.300mol Cu,此时在另一电极上放出的气体在标准状况下的体积为( )
| A、3.36L |
| B、6.72L |
| C、5.60L |
| D、大于5.60L,小于6.72L |
下列反应条件的控制中,不恰当的是( )
| A、为了防止铁生锈,在其表面涂一层防锈油漆 |
| B、为防止火灾,在面粉厂、加油站等场所要严禁烟火 |
| C、为加快KClO3的分解速率,加入MnO2 |
| D、为加快H2O2的分解速率,把反应容器放到冷水中冷却 |
在蒸馏实验中,下列叙述不正确的是( )
| A、在蒸馏烧瓶中加入碎瓷片防止暴沸 |
| B、将温度计水银球插入自来水中 |
| C、冷水从冷凝管下口入,上口出 |
| D、收集蒸馏水时,应弃去开始馏出的部分 |
T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论不正确的是( )


| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B、保持其他条件不变,升高温度,反应的化学平衡常数K增大 |
| C、反应进行的前3min内,用X表示的反应速率v(X)=0.1mol/(L?min) |
| D、若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
 存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.
存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.