题目内容
把1mL0.1mol/L的H2SO4溶液加入蒸馏水中,制成200ml溶液,稀释后的H2SO4中,由水自身电离产生的c(H+)最接近( )
| A、1×10-13mol/L |
| B、1×10-3mol/L |
| C、1×10-7mol/L |
| D、1×10-11mol/L |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:酸抑制水的电离,故水自身电离产生的c(H+)等于c(OH-),依此结合离子积进行计算.
解答:
解:1mL0.1mol/L的H2SO4溶液加入蒸馏水中,制成200ml溶液,硫酸的浓度为:
=5×10-4mol/L,则c(H+)=5×10-4mol/L×2=1×10-3mol/L,故c(OH-)=
=1×10-11mol/L,故c(H+)水=c(OH-)=1×10-11mol/L,
故选D.
| 0.1 |
| 200 |
| 1×10-14 |
| 1×10-3 |
故选D.
点评:本题考查水的电离及相关离子浓度的计算,难度中等,要注意酸碱抑制水的电离.

练习册系列答案
相关题目
某有机化合物的结构简式如图:
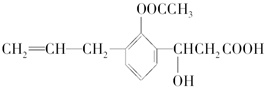
此有机化合物属于( )
①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥芳香化合物.

此有机化合物属于( )
①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥芳香化合物.
| A、①②③④⑥ | B、②④⑥ |
| C、②④⑤⑥ | D、①③⑤ |
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN═CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )
| A、CO为氧化产物,H2为还原产物 |
| B、CaCN2中含有非极性键 |
| C、HCN既是氧化剂又是还原剂 |
| D、每消耗10g CaCO3生成2.24L CO2 |
下列说法正确的是( )
| A、向0.01 mol?L-1醋酸溶液中加水,溶液中水电离产生的c(H+) 将减小 | ||
| B、将水加热,KW增大,pH不变,仍呈中性 | ||
| C、向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变 | ||
D、c(H+)=
|
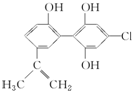 禁止运动员使用兴奋剂是保证比赛公平、公正的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )
禁止运动员使用兴奋剂是保证比赛公平、公正的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )| A、1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH |
| B、1 mol X与足量浓溴水反应,最多消耗4 mol Br2 |
| C、X遇FeCl3溶液显色,可看作酚类物质 |
| D、兴奋剂X所有碳原子有可能共平面 |
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: