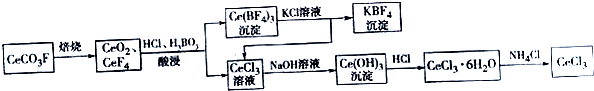
题目内容
4.实验室里需用480mL 0.1mol/L的硫酸铜溶液,配制时应选择的容量瓶的规格和需要称量的溶质的质量分别为( )| A. | 480mL容量瓶,7.68g硫酸铜 | B. | 480mL容量瓶,12.0g胆矾 | ||
| C. | 500mL容量瓶,12.5g硫酸铜 | D. | 500mL容量瓶,12.5g胆矾 |
分析 依据配制溶液体积和实验室常用容量瓶规格选择合适 容量瓶,依据m=cVM计算需要硫酸铜、胆矾胆矾质量,据此解答.
解答 解:需用480mL 0.1mol/L的硫酸铜溶液,实验室没有480mL容量瓶,应选择500mL容量瓶,需要硫酸铜的质量m=0.1mol/L×0.5L×160g/mol=8.0g;需要胆矾的质量m═0.1mol/L×0.5L×250g/mol=12.5g,
故选:D.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择,题目难度不大.

练习册系列答案
相关题目
2.工业上利用电镀污泥 (主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质) 回收铜和铬等金属,回收流程如图1:
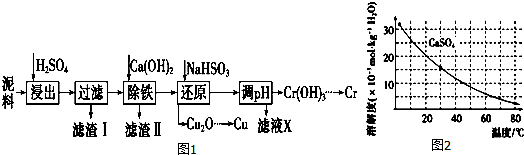
已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有CuSO4.
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].

已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].