题目内容
10.在反应Cl2+2NaOH═NaCl+NaClO+H2O的变化中,当产生58.5gNaCl时,转移电子总数是( )| A. | 1.204×1024个 | B. | 6.02×1023个 | C. | 4.816×1023个 | D. | 2.408×1023个 |
分析 Cl2+2NaOH=NaCl+NaClO+H2O中,Cl元素的化合价由0升高为+1价,由0降低为-1价,转移电子数为1e-,以此来解答.
解答 解:Cl2+2NaOH=NaCl+NaClO+H2O中,Cl元素的化合价由0升高为+1价,由0降低为-1价,转移电子数为1e-,所以当产生58.5gNaCl时,转移电子总数是$\frac{58.5}{58.5}$×1×6.02×1023=6.02×1023个;
故选B.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注意转移电子数的计算,题目难度不大.

练习册系列答案
相关题目
19.Al-Ag2O电池可用作水下动力电源,其原理如图所示,电池工作时,下列说法错误的是( )


| A. | 电子由Al电极通过外电路流向Ag2O/Ag电极 | |
| B. | 电池负极附近溶液pH升高 | |
| C. | 正极反应式为:Ag2O+2e-+H2O=2Ag+2OH- | |
| D. | 负极会发生副反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
1.下列各组物质之间通过一步就能实现如图所示转化的是( )
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① | 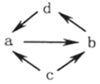 | NO | NO2 | N2 | HNO3 |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
| ③ | SiO2 | Na2SiO3 | Si | H2SiO3 | |
| ④ | SO2 | SO3 | S | H2SO4 |
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①③ |
18.下列离子方程式书写正确的是( )
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 新制氯水中:Cl2+H2O?2H++ClO-+Cl- | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
5.下列说法正确的是( )
| A. | 加热胆矾失去结晶水,得到白色无水硫酸铜,这一过程叫风化 | |
| B. | 家用石碱(主要成分是Na2CO3•10H2O )久置后,由块状变成粉末状,这一变化是风化的结果 | |
| C. | 含有水蒸气的气体通过固体NaOH 时,固体表面出现水珠,这是固体氢氧化钠潮解的原故 | |
| D. | 从冰箱取出物品,表面很快出现水珠,这种现象叫潮解 |
15.下列对分子的性质的解释中,不正确的是( )
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 乳酸[CH3CH(OH)COOH]有一对对映异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | SiCl4的分子中硅氯键的极性比CCl4中的碳氯键强 |
2.下列物质中属于同系物的是( )
①CH3CH2Cl ②CH2=CHCl ③CH3CH2CH2Cl ④CH2ClCH2Cl ⑤CH3CH2CH2CH3⑥CH3CH(CH3)2.
①CH3CH2Cl ②CH2=CHCl ③CH3CH2CH2Cl ④CH2ClCH2Cl ⑤CH3CH2CH2CH3⑥CH3CH(CH3)2.
| A. | ①②④ | B. | ①④ | C. | ①③ | D. | ⑤⑥ |
20.CaS可用于制备发光漆、用作脱毛剂、杀虫剂、硫脲等,还用于医药工业、重金属处理及环保中.某化学探究小组在实验室中利用反应:CaSO4+C$\stackrel{高温}{→}$CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下.回答下列问题:
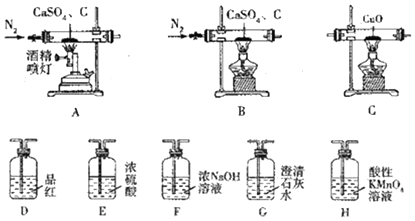
已知:①C及E~H中的试剂均为足量.
②酸性KMnO4溶液作氧化剂时,锰元素被还原成Mn2+
③CaS与H2O反应生成Ca(OH)2和H2S.
(1)实验1:若只检验生成物中是否含有CO,可采用的装置组合为AFECG(AFGECG或AFEC或AC)(按气流方向,填字母组合),生成物中存在CO的现象是装置C中黑色固体变为红色,装置G中澄清石灰水变浑浊.
(2)实验2:若只检验生成物中是否含有CO2,可釆用的最简单的装置组合为AHG(按气流方向,填字母组合),除去SO2的离子方程式为5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+.
(3)实验3:若同时检验CO2和SO2,采用的装置组合为ADHG或AHG(按气流方向,填字母组合).
(4)若制备反应的条件完全相同,将产生的气体全部通入上述实验装置中,得到的有关数据如表:
写出CaSO4和焦炭在高温条件下反应生成CaS的化学方程式:2CaSO4+3C$\frac{\underline{\;高温\;}}{\;}$CaS+CaO+SO2↑+2CO2↑+CO↑.
(5)为了证明硫化钙的化学式设计如下实验:将一定质量(m1)的样品溶于足量的饱和Na2CO3溶液中,通过过滤、洗涤、干燥操作,称得固体质量为m2,则表示硫化钙组成的计算式为n(Ca):n(S)=$\frac{{m}_{2}}{100}:\frac{5{m}_{1}-2{m}_{2}}{160}$(用含m1、m2的代数式表示).

已知:①C及E~H中的试剂均为足量.
②酸性KMnO4溶液作氧化剂时,锰元素被还原成Mn2+
③CaS与H2O反应生成Ca(OH)2和H2S.
(1)实验1:若只检验生成物中是否含有CO,可采用的装置组合为AFECG(AFGECG或AFEC或AC)(按气流方向,填字母组合),生成物中存在CO的现象是装置C中黑色固体变为红色,装置G中澄清石灰水变浑浊.
(2)实验2:若只检验生成物中是否含有CO2,可釆用的最简单的装置组合为AHG(按气流方向,填字母组合),除去SO2的离子方程式为5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+.
(3)实验3:若同时检验CO2和SO2,采用的装置组合为ADHG或AHG(按气流方向,填字母组合).
(4)若制备反应的条件完全相同,将产生的气体全部通入上述实验装置中,得到的有关数据如表:
| 实验前 | 实验后 | |
| 实验1 | 装置C硬质玻璃管连同CuO质量为26.80g | 装置C硬质玻璃管连同反应后固体质量为26.64g |
| 实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38g |
| 实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24g |
(5)为了证明硫化钙的化学式设计如下实验:将一定质量(m1)的样品溶于足量的饱和Na2CO3溶液中,通过过滤、洗涤、干燥操作,称得固体质量为m2,则表示硫化钙组成的计算式为n(Ca):n(S)=$\frac{{m}_{2}}{100}:\frac{5{m}_{1}-2{m}_{2}}{160}$(用含m1、m2的代数式表示).
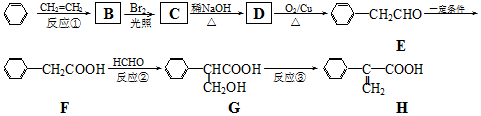
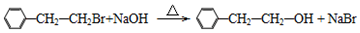 .
.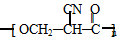 (要重新写过) 的合成路线:NCCH2CHO$→_{△}^{新制Cu(OH)_{2}}$ $\stackrel{H+}{→}$
(要重新写过) 的合成路线:NCCH2CHO$→_{△}^{新制Cu(OH)_{2}}$ $\stackrel{H+}{→}$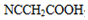 →
→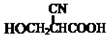 →
→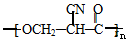 .
.