题目内容
19.Al-Ag2O电池可用作水下动力电源,其原理如图所示,电池工作时,下列说法错误的是( )
| A. | 电子由Al电极通过外电路流向Ag2O/Ag电极 | |
| B. | 电池负极附近溶液pH升高 | |
| C. | 正极反应式为:Ag2O+2e-+H2O=2Ag+2OH- | |
| D. | 负极会发生副反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
分析 原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,Ag2O被还原,应为原电池的正极,电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,以此解答该题.
解答 解:A.铝为负极,被氧化,Ag2O/Ag为正极,原电池工作时,电子由Al电极通过外电路流向Ag2O/Ag电极,故A正确;
B.负极发生Al-3e-+4OH-=AlO2-+2H2O,则pH减小,故B错误;
C.正极发生还原反应,电极方程式为Ag2O+2e-+H2O=2Ag+2OH-,故C正确;
D.由于电解质呈碱性,铝可与氢氧化钠溶液反应2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故D正确.
故选B.
点评 本题考查化学电源新型电池,为高频考点,侧重考查学生的分析能力,题目难度中等,解答本题的关键是能正确书写电极方程式,做题时注意体会书写方法.

练习册系列答案
相关题目
9.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 在标况下,22.4LSO3和22.4LC2H4原子个数比为2:3 | |
| B. | 将78gNa2O2与过量CO2反应转移的电子数为2NA | |
| C. | 28g乙烯分子中含有极性共价键的数目为6NA | |
| D. | 1molNaCl晶体中含有NA个Na+ |
10.实验室需要用500mL 1.0mol/L Na2CO3溶液进行相关实验,下列有关配制该溶液的说法不正确的是( )
| A. | 用托盘天平称取53.0g Na2CO3固体 | |
| B. | 需要的玻璃仪器有500mL容量瓶、烧杯、玻璃棒、胶头滴管、量筒 | |
| C. | 转移溶液时有少量液体溅出,则最终溶液的浓度偏高 | |
| D. | 定容时仰视刻度线,则最终溶液的浓度偏低 |
12.下列应用涉及氧化还原反应的是( )
| A. | 人工固氮 | B. | 粗盐提纯 | C. | 工业制氧 | D. | 玻璃刻字 |
9.下列说法正确的是( )
| A. | 在相同条件下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度不相同 | |
| B. | 反应NH3(g)+HCl(g)?NH4Cl(s)能自发进行,则该反应△H<0 | |
| C. | 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了 c(H+) | |
| D. | 一定条件下,反应2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡后,升高体系温度,应重新达到平衡前,有v正(O2)>2v逆(SO2) |
10.在反应Cl2+2NaOH═NaCl+NaClO+H2O的变化中,当产生58.5gNaCl时,转移电子总数是( )
| A. | 1.204×1024个 | B. | 6.02×1023个 | C. | 4.816×1023个 | D. | 2.408×1023个 |
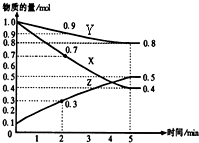 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示: