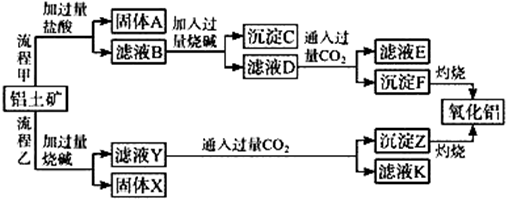
题目内容
9.下列化学用语表达正确的是( )| A. | 丙烷的球棍模型: | B. | S2-的结构示意图: | ||
| C. | CO2的电子式:O=C=O | D. | 乙烯的结构简式:CH2CH2 |
分析 A.球棍模型中,用大小不同的小球表示原子,用短棍表示共价键;
B.硫离子的核电荷数为16,不是18;
C.电子式中需要标出最外层电子;
D.乙烯的结构简式中漏掉了官能团碳碳双键.
解答 解:A.丙烷分子中含有两个甲基、1个亚甲基,丙烷的球棍模型为: ,故A正确;
,故A正确;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为 ,故B错误;
,故B错误;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其正确的电子式为 ,故C错误;
,故C错误;
D.乙烯分子中含有碳碳双键,乙烯的结构简式为:CH2═CH2,故D错误;
故选A.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握结构简式、离子结构示意图、球棍模型、电子式等化学用语的概念及表示方法,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
相关题目
20.下列叙述中,正确的是( )
| A. | 14C中含有14个中子 | |
| B. | 1H、2H、3H是同一种核素 | |
| C. | H2O与D2O(重水)互称同位素 | |
| D. | C60、C70、金刚石、石墨均为碳的同素异形体 |
17.19世纪门捷列夫的突出贡献是( )
| A. | 发现了元素周期律 | B. | 提出了原子学说 | ||
| C. | 发现了稀有气体 | D. | 提出了分子学说 |
4.一定温度下,反应A2(g)+B2(g)═2AB(g)达到平衡的标志是( )
| A. | 混合气体中各物质的浓度相等 | |
| B. | 单位时间内生成2nmolAB同时生成nmolB2 | |
| C. | 单位时间内生成nmolA2同时生成nmolB2 | |
| D. | 单位时间内生成nmolA2同时生成nmolAB |
19.用粗氧化铜(含少量Fe)制取纯净的CuCl2?2H2O的主要过程是:
①将粗氧化铜溶解于稀盐酸中,加热、过滤.调节滤液的pH为3;
②对①所得的滤液按下列步骤进行操作:
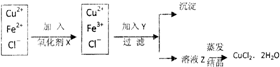
已知:
回答下列问题:
(1)加入氧化剂X的目的是:将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离
本实验最合适的氧化剂X是c(填字母)
a.K2Cr2O7 b.NaClO c.H2O2 d.KMnO4
反应的离子方程式是2H++H2O2+2Fe2+=2Fe3++2H2O.
(2)Y可选:CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3,调节pH3.2≤pH<4.7
除去Fe3+的有关离子方程式为CuO+2H+=Cu2++H2O、Fe3++3H2O=Fe(OH)3+3H+
(3)采用低温减压蒸发结晶的方法得到CuCl?2H2O的晶体,还要在过程中不断通入HCl气体,且不能蒸干.
①将粗氧化铜溶解于稀盐酸中,加热、过滤.调节滤液的pH为3;
②对①所得的滤液按下列步骤进行操作:

已知:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
(1)加入氧化剂X的目的是:将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离
本实验最合适的氧化剂X是c(填字母)
a.K2Cr2O7 b.NaClO c.H2O2 d.KMnO4
反应的离子方程式是2H++H2O2+2Fe2+=2Fe3++2H2O.
(2)Y可选:CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3,调节pH3.2≤pH<4.7
除去Fe3+的有关离子方程式为CuO+2H+=Cu2++H2O、Fe3++3H2O=Fe(OH)3+3H+
(3)采用低温减压蒸发结晶的方法得到CuCl?2H2O的晶体,还要在过程中不断通入HCl气体,且不能蒸干.
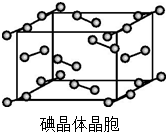 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.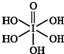 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”“<”或“=”).
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”“<”或“=”).




 或
或 (任写一种).
(任写一种). .
.