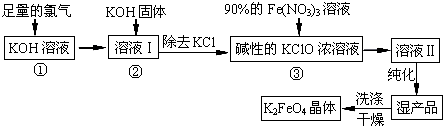
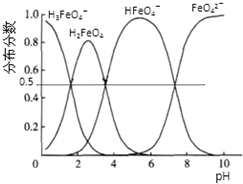
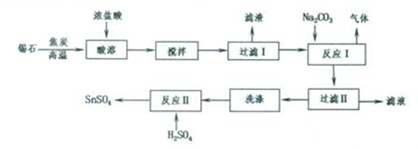
题目内容
17.19世纪门捷列夫的突出贡献是( )| A. | 发现了元素周期律 | B. | 提出了原子学说 | ||
| C. | 发现了稀有气体 | D. | 提出了分子学说 |
分析 俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表.
解答 解:1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循,故选A.
点评 本题考查化学史,熟记化学发展史中各科学家所作出的巨大贡献即可解答,题目较简单.

练习册系列答案
相关题目
5.在1~18号元素中,最外层上的电子数与电子层数相同,该元素可能有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
12.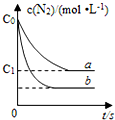 汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
 汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | 曲线b对应的条件改变可能是加入了催化剂 | |
| B. | 温度T下,随着反应的进行,混合气体的密度减小 | |
| C. | 温度T下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应是吸热反应 |
2.2011年,瑞士洛桑联邦工学院无理学家发现后用一种辉钼(MoS2)单分子层材料制造半导体,比传统硅材料和富勒烯更有优势.工业上用辉钼矿冶炼钼的化学原理:
①2MoS2+7O2$\stackrel{高温}{→}$2MoO3+4SO2 ②MoO3+2NH3•H2O═(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl═H2MoO4↓+2NH4Cl ④H2MoO4═MoO3+H2O
⑤用还原剂将MoO3还原成金属钼,下列说法正确的是( )
①2MoS2+7O2$\stackrel{高温}{→}$2MoO3+4SO2 ②MoO3+2NH3•H2O═(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl═H2MoO4↓+2NH4Cl ④H2MoO4═MoO3+H2O
⑤用还原剂将MoO3还原成金属钼,下列说法正确的是( )
| A. | MoS2煅烧产生的尾气可直接排到空气中 | |
| B. | MoO3不溶于氢氧化钠溶液 | |
| C. | H2MoO4是一种强酸 | |
| D. | 利用H2、CO和Al分别还原等量的MoO3,消耗还原剂的物质的量之比为3:3:2 |
9.下列化学用语表达正确的是( )
| A. | 丙烷的球棍模型: | B. | S2-的结构示意图: | ||
| C. | CO2的电子式:O=C=O | D. | 乙烯的结构简式:CH2CH2 |
6.橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如图
下列关于橙花醇的叙述,正确的是( )

下列关于橙花醇的叙述,正确的是( )
| A. | 橙花醇的分子式为C15H24O | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 在一定条件下能发生取代、催化氧化、酯化、加聚反应 | |
| D. | 0.1mo1橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗0.3mo1Br2 |
7.用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4•H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是二氧化硅.
(2)将MnO2氧化Fe2+的离子方程式补充完整:
□MnO 2+□Fe 2++□═Mn 2++□Fe 3++□□
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、不会引入Cl-,使制得的MnSO4?H2O产品更纯净.
(4)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是4.7≤a<7.6.
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4-与Mn2+反应生成MnO2.取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为$\frac{1.5y×1{0}^{-4}×55}{x}$.
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是二氧化硅.
(2)将MnO2氧化Fe2+的离子方程式补充完整:
□MnO 2+□Fe 2++□═Mn 2++□Fe 3++□□
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、不会引入Cl-,使制得的MnSO4?H2O产品更纯净.
(4)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
步骤Ⅲ中a的取值范围是4.7≤a<7.6.
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4-与Mn2+反应生成MnO2.取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为$\frac{1.5y×1{0}^{-4}×55}{x}$.