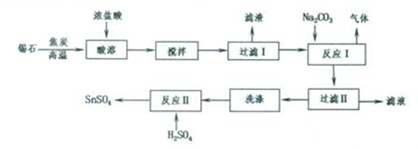
题目内容
20.下列叙述中,正确的是( )| A. | 14C中含有14个中子 | |
| B. | 1H、2H、3H是同一种核素 | |
| C. | H2O与D2O(重水)互称同位素 | |
| D. | C60、C70、金刚石、石墨均为碳的同素异形体 |
分析 A.原子符号中左上角为质量数,左下角为质子数,质量数=质子数+中子数;
B.具有一定质子数和一定中子数的原子为一种核素;
C.质子数相同中子数不同的同种元素的不同原子为同位素;
D.同种元素组成的不同单质为同素异形体.
解答 解:A.14C中含有中子数=14-6=8,故A错误;
B.1H、2H、3H是质子数相同,中子数不同的同一氢元素的不同种核素,是三种核素,故B错误;
C.H2O与D2O是化合物,不是原子,不是同位素,故C错误;
D.C60、C70、金刚石、石墨都是碳元素形成的不同单质,均为碳的同素异形体,故D正确;
故选D.
点评 本题考查了原子结构、同位素、核素、同素异形体等概念的分析判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
20.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,22.4L O2所含的原子数为2NA | |
| B. | 标准状况下,22.4L H2所含的分子数为NA | |
| C. | 标准状况下,22.4L H2O所含的分子数为NA | |
| D. | 56g铁粉与盐酸完全反应时转移电子数为3NA |
11.38.4g铜与过量稀硝酸充分反应,发生还原反应的HNO3的物质的量为( )
| A. | 1.2mol | B. | 1.6mol | C. | 0.4mol | D. | 0.2mol |
5.在1~18号元素中,最外层上的电子数与电子层数相同,该元素可能有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
12.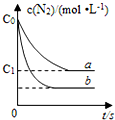 汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
 汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | 曲线b对应的条件改变可能是加入了催化剂 | |
| B. | 温度T下,随着反应的进行,混合气体的密度减小 | |
| C. | 温度T下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应是吸热反应 |
9.下列化学用语表达正确的是( )
| A. | 丙烷的球棍模型: | B. | S2-的结构示意图: | ||
| C. | CO2的电子式:O=C=O | D. | 乙烯的结构简式:CH2CH2 |
10.下列有关物质应用的说法正确的是( )
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去油脂 | |
| B. | 硝酸与铁发生化学反应,不可用铁制容器盛装浓硝酸 | |
| C. | 铝表面易形成致密的氧化膜,铝制器皿可长时间盛放咸菜等腌制食品 | |
| D. | H2与Cl2光照发生爆炸,工业上不能用H2与Cl2做原料生产HCl |