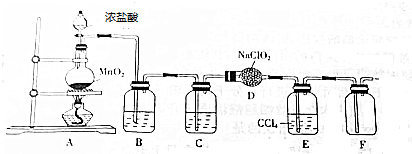
题目内容
11.分子式为C5H10O3的有机物,在浓硫酸存在下加热可生成具有特殊香味且不溶于水的物质,则符合上述条件的C5H10O3最多(不考虑立体异构)有( )| A. | 12种 | B. | 11种 | C. | 9种 | D. | 7种 |
分析 在浓硫酸存在下加热可生成具有待殊香味且不溶于水的物质为酯类物质,分子中含有一个羟基和一个羧基,据此解题.
解答 解:在浓硫酸存在下加热可生成具有待殊香味且不溶于水的物质为酯类物质,分子中含有一个羟基和一个羧基,该有机物可以看作,C4H10中2个H原子,分别被-COOH、-OH代替,
若C4H10为正丁烷:CH3CH2CH2CH3,2个H原子分别被-COOH、-OH代替,都取代同一碳原子上2个H原子,有2种,取代不同C原子的2个H原子,有6种,相应的同分异构体有8种;
若C4H10为异丁烷:CH3CH(CH2)CH3,2个H原子分别被-COOH、-OH代替,都取代同一碳原子上2个H原子,有1种,取代不同C原子的2个H原子,有3种,相应的同分异构体有4种;
故该有机物的可能的结构有8+4=12种.
故选A.
点评 本题考查同分异构体的书写,判断有机物含有的官能团是关键,注意取代中利用定一移二进行判断,难度中等.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
19. 近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
(1)以下可能引起细颗粒物指标变高的是abdef(填序号).
a.燃煤取暖 b.大型交通设备 c.生活污水 d.火山喷发 e.局部战争 f.采矿业
(2)如图是某地光化学烟雾的日变化曲线:据图所示,上午8:00,非甲烷烃和NO出现峰值. 随后NO2约于10:00达峰值,其主要反应的方程式可能为2NO+O2=2NO2.8:00起,O3开始积累,并于13:00达峰值,O3积累与下列过程有关:O+O2→O3,该反应物中游离的氧原子主要是由反应:NO2=NO+O产生的.O3又使10:00前NO2的含量急剧增加,其化学方程式为O3+NO=NO2+O2.你认为该地光化学烟雾较严重的时间最可能为c(填序号).
a.8:00 b.10:00 c.15:00 d.20:00
(3)若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2与N2O4的平衡混合物密度为3.18g/L时,混合气体的平均摩尔质量为77.9g/mol,N2O4的分解率(即转化率)为53.1%.(计算结果均保留三位有效数字).
(4)NO、NO2、NH4+及NO2-等被称为活性氮物质,超量排放会引起环境问题.NH4+与NO2-可发生下列反应:NH4+(aq)+NO2-(aq)═N2(g)+2H2O(l)可加快该反应的措施为升温、增大反应物浓度.该反应的反应速率方程为ν=k•c(NH4+)x•c(NO2-)y,其中k为速率常数,在一定温度下,进行下列实验:
据表知,将溶液稀释至原体积的2倍,反应速度将变为原来的$\frac{1}{4}$.
 近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:(1)以下可能引起细颗粒物指标变高的是abdef(填序号).
a.燃煤取暖 b.大型交通设备 c.生活污水 d.火山喷发 e.局部战争 f.采矿业
(2)如图是某地光化学烟雾的日变化曲线:据图所示,上午8:00,非甲烷烃和NO出现峰值. 随后NO2约于10:00达峰值,其主要反应的方程式可能为2NO+O2=2NO2.8:00起,O3开始积累,并于13:00达峰值,O3积累与下列过程有关:O+O2→O3,该反应物中游离的氧原子主要是由反应:NO2=NO+O产生的.O3又使10:00前NO2的含量急剧增加,其化学方程式为O3+NO=NO2+O2.你认为该地光化学烟雾较严重的时间最可能为c(填序号).
a.8:00 b.10:00 c.15:00 d.20:00
(3)若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2与N2O4的平衡混合物密度为3.18g/L时,混合气体的平均摩尔质量为77.9g/mol,N2O4的分解率(即转化率)为53.1%.(计算结果均保留三位有效数字).
(4)NO、NO2、NH4+及NO2-等被称为活性氮物质,超量排放会引起环境问题.NH4+与NO2-可发生下列反应:NH4+(aq)+NO2-(aq)═N2(g)+2H2O(l)可加快该反应的措施为升温、增大反应物浓度.该反应的反应速率方程为ν=k•c(NH4+)x•c(NO2-)y,其中k为速率常数,在一定温度下,进行下列实验:
| 实验序号 | c(NH4+)/mol•L-1 | c(NO2-)/mol•L-1 | ν/mol•L-1•s-1 |
| 1 | 0.0100 | 0.200 | 5.4×10-7 |
| 2 | 0.0200 | 0.200 | 1.08×10-6 |
| 3 | 0.200 | 0.040 | 2.16×10-6 |
| 4 | 0.200 | 0.060 | 3.24×10-6 |
6. 已知连二次硝酸(H2N2O2)是一种二元酸,25℃时,用0.01mol.L-1的盐酸滴定10mL0.01mol.L-1Na2N2O2溶液,溶液的pH与盐酸体积[V(HCl)]的关系如图所示.下法说法正确的是( )
已知连二次硝酸(H2N2O2)是一种二元酸,25℃时,用0.01mol.L-1的盐酸滴定10mL0.01mol.L-1Na2N2O2溶液,溶液的pH与盐酸体积[V(HCl)]的关系如图所示.下法说法正确的是( )
 已知连二次硝酸(H2N2O2)是一种二元酸,25℃时,用0.01mol.L-1的盐酸滴定10mL0.01mol.L-1Na2N2O2溶液,溶液的pH与盐酸体积[V(HCl)]的关系如图所示.下法说法正确的是( )
已知连二次硝酸(H2N2O2)是一种二元酸,25℃时,用0.01mol.L-1的盐酸滴定10mL0.01mol.L-1Na2N2O2溶液,溶液的pH与盐酸体积[V(HCl)]的关系如图所示.下法说法正确的是( )| A. | M点的溶液中加人少量水,溶液的pH增大 | |
| B. | N点溶液中:c(N2O22-)+c(OH-)>c(H2N2O2) | |
| C. | P点溶液中,H2O不发生电离 | |
| D. | 溶液中$\frac{c({H}^{+})}{c(H{N}_{2}{{O}_{2}}^{-})}$:N>P>Q. |
3.某短周期元素X,其原子的电子层数为n,最外层电子数为2n+1.下列有关元素X的说法错误的是( )
| A. | 元素X不可能是金属元素 | |
| B. | 元素X的气态氢化物易溶于水 | |
| C. | 元素X能形成化学式为KXO3的盐 | |
| D. | 工业上制取X的单质时一定采用氧化还原反应 |
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24LCl2溶于足量水中转移电子的数目为0.1NA | |
| B. | 标准状况下,22.4L苯中含有双键的数目为3NA | |
| C. | 常温下,16gO2和O3的混合气体中含有氧原子的数目为NA | |
| D. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA |

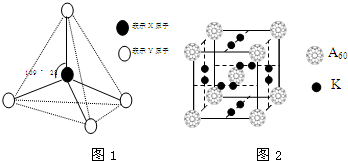 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.工业上利用单质A的同素异形体能与B物质发生置换反应,制取单质G的粗产品.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.工业上利用单质A的同素异形体能与B物质发生置换反应,制取单质G的粗产品.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.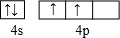 .
.
 .
.