题目内容
3.某短周期元素X,其原子的电子层数为n,最外层电子数为2n+1.下列有关元素X的说法错误的是( )| A. | 元素X不可能是金属元素 | |
| B. | 元素X的气态氢化物易溶于水 | |
| C. | 元素X能形成化学式为KXO3的盐 | |
| D. | 工业上制取X的单质时一定采用氧化还原反应 |
分析 短周期元素X,其原子的电子层数为n,最外层电子数为2n+1,则n=2时,最外层电子数为5,为N元素;n=3时,最外层电子数为7,为Cl元素,以此来解答.
解答 解:短周期元素X,其原子的电子层数为n,最外层电子数为2n+1,则n=2时,最外层电子数为5,为N元素;n=3时,最外层电子数为7,为Cl元素,
A.由上述分析可知,X为N或Cl,为非金属元素,故A正确;
B.氨气或HCl均易溶于水,故B正确;
C.X为N时能形成化学式为KXO3的盐,故C正确;
D.X为N时,分离氮气利用液化法,为物理方法,故D错误;
故选D.
点评 本题考查原子结构与元素的性质,为高频考点,把握原子结构与元素的推断为解答的关键,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
14.下列表示物质变化的式子错误的是( )
| A. | 氯气通入水中 Cl2+H2O?H++Cl-+HClO | |
| B. | 甲烷的完全燃烧CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$ CO2(g)+2H2O(l)△H<0 | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应 2Fe+3H2O$\frac{\underline{\;高温\;}}{\;}$ Fe2O3+3H2 |
18.X、Y、Z、R、W是原子序数依次增大的短周期元素,X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为19,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨.下列说法中正确的是( )
| A. | 最高价氧化物对应水化物酸性:X>R | |
| B. | 离子半径:Z>W | |
| C. | pH=10的Na2R溶液.由水电离出的c(H+)=10-10mol•L-1 | |
| D. | 气态氢化物稳定性:W>R |
5.设NA为阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 常温下,0.1 mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| B. | 标准状况下22.4 L H2O所含分子数为NA | |
| C. | 1 L 0.5 mol•L-1 CH3COOH溶液中,CH3COO-的个数为0.5NA | |
| D. | 在NO、NO2的混合气体22.4 L中,含有的氮原子数为NA个 |

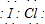 ,该化合物中显正价的是I元素.
,该化合物中显正价的是I元素. (用电子式表示).
(用电子式表示).