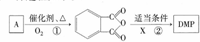
题目内容
12.把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)═nZ(g)+2W(g) 1min末已生成0.2mol W,若测知以Z的浓度变化表示的反应速率为0.005mol•L-1•s-1,计算:(1)前1min内用X的浓度变化表示的平均反应速率.
(2)1min末时Y的浓度.
(3)化学反应方程式中n的值是多少?
分析 (1)根据v=$\frac{\frac{△n}{V}}{△t}$计算出前1min内用X的浓度变化表示的平均反应速率;
(2)根据1min末已生成0.2mol W计算出消耗Y的物质的量,然后根据c=$\frac{n}{V}$计算出1min末时Y的浓度;
(3)根据反应速率与化学计量数成正比计算出n.
解答 解:(1)前1min内用X的浓度变化表示的平均反应速率为:v(X)=$\frac{\frac{0.2mol}{2L}}{1min}$=0.1mol•L-1•min-1,
答:前1min内用X的浓度变化表示的平均反应速率为0.1 mol•L-1•min-1;
(2)根据反应2X(g)+Y(g)═nZ(g)+2W(g)可知,1min末时消耗Y的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,则1min时Y的浓度为:c(Y)=$\frac{0.6mol-0.1mol}{2L}$=0.25mol/L,
答:1min末时Y的浓度为0.25 mol/L;
(3)1min内用X的浓度变化表示的平均反应速率为v(X)=0.1mol•L-1•min-1,以Z的浓度变化表示的反应速率为0.005mol•L-1•s-1=0.3mol•L-1•min-1,反应速率与化学计量数成正比,则:0.1mol•L-1•min-1:0.3mol•L-1•min-1=2:n,解得:n=6,
答:化学反应方程式中n=6.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学反应速率、物质的量浓度的计算及化学反应速率与化学计量数的关系,明确化学反应速率的概念及表达式为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.下列设计的实验方案能达到实验目的是( )
| A. | 制备Fe(OH)3胶体:0.2 mol•L-1 FeCl3溶液与0.6 mol•L-1 NaOH溶液等体积混合 | |
| B. | 排除碱式滴定管尖嘴部分的气泡:将胶管弯曲使玻璃尖嘴端向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 | |
| C. | 测定浓度均为0.1mol•L-1 CH3COONa与HCOONa溶液的pH,不能比较CH3COOH与HCOOH酸性的强弱 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
20.过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域.用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素.反应的方程式为:CO(NH2)2+H2O2$\frac{\underline{\;30℃\;}}{\;}$CO(NH2)2•H2O2.过氧化尿素的部分性质如下:
合成过氧化尿素的流程如图1及反应装置图如图2: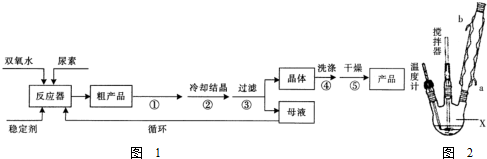
请回答下列问题:
(1)仪器X的名称是三颈烧瓶;冷凝管中冷却水从b(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是防止双氧水和过氧化尿素分解.
(3)搅拌器是否可用铁质材料否(填“是”或“否”),原因是铁和双氧水反应生成铁离子,促进双氧水分解;
(4)步骤①宜采用的操作是C.
A.加热蒸发 B.常压蒸发 C.减压蒸发
(5)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是沿玻璃棒注入蒸馏水至浸没晶体表面,静置待水自然流下,重复操作2-3次.
(6)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol•L-1H2SO4,用0.2000mol•L-1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为84.6%;若滴定后俯视读数,则测得的过氧化尿素含量偏低(填“偏高”、“偏低”或“不变”).
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |

请回答下列问题:
(1)仪器X的名称是三颈烧瓶;冷凝管中冷却水从b(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是防止双氧水和过氧化尿素分解.
(3)搅拌器是否可用铁质材料否(填“是”或“否”),原因是铁和双氧水反应生成铁离子,促进双氧水分解;
(4)步骤①宜采用的操作是C.
A.加热蒸发 B.常压蒸发 C.减压蒸发
(5)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是沿玻璃棒注入蒸馏水至浸没晶体表面,静置待水自然流下,重复操作2-3次.
(6)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol•L-1H2SO4,用0.2000mol•L-1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为84.6%;若滴定后俯视读数,则测得的过氧化尿素含量偏低(填“偏高”、“偏低”或“不变”).
7.下列说法中不正确的是( )
| A. | 位于周期表中同一周期的元素,原子具有相同的电子层数 | |
| B. | 凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数 | |
| C. | 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8 | |
| D. | 凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增 |
4.下列对实验现象的预测与实际相符的是( )
| 选项 | 实验 | 预测现象 |
| A | 将SO2通入紫色石蕊溶液中 | 石蕊溶液先变红后褪色 |
| B | 将CO2气体通入足量的CaCl2溶液中 | 产生白色沉淀 |
| C | 常温下,将用砂纸打磨过的铝片投入浓硫酸中 | 产生刺激性气体 |
| D | 将酸性高锰酸钾溶液滴入足量的乙醇中 | 高锰酸钾溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
2.25℃时,已知Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10,Ksp(Ag2C2O4)=3.5×10-11,Ksp(AgI)=1.5×10-16,该温度下有关叙述正确的是( )
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
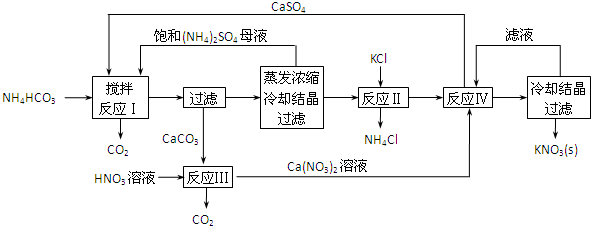
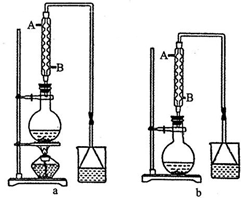 实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题. )是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示:
)是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示: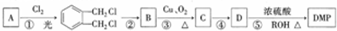
 .
. .
.