题目内容
12.物质发生化学反应时:①电子总数;②质子总数;③物质的结构;④分子总数;⑤物质所具有的总能量;⑥物质的总质量.反应前后肯定发生变化的是( )| A. | ①② | B. | ⑤⑥ | C. | ④⑥ | D. | ③⑤ |
分析 根据质量守恒定律的内容可知,在化学反应中,反应前后肯定不会发生变化的是:元素的种类、物质的质量总和、各种原子的数目;而物质的结构一定变化,也会发生能量变化.
解答 解:①在反应过程中,一定满足得失电子数守恒,故电子数一定不变,故①不选;
②化学变化中各种原子的数目,所以原子总数不发生变化,则质子总数不变,故②不选;
③化学反应过程中会生成新物质,所以物质的结构一定会发生变化,故③选;
④化学变化中分子总数可能变化,可能不变,可根据化学计量数判断,所以分子总数不一定变化,故④不选;
⑤化学反应伴随能量变化,有的吸收能量,有的反应放出能量,物质所具有的总能量一定发生变化,故⑤选;
⑥化学反应过程中一定满足原子种类和个数守恒,即一定满足质量守恒,故反应前后物质的总质量一定不变,故⑥不选;
故选D.
点评 本题考查了化学反应的特征,题目涉及电子得失数守恒、原子种类和个数守恒、质量守恒和能量守恒,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.烟气中含有SO2等大量有害的物质,烟气除硫的方法有多种,其中石灰石法烟气除硫工艺的主要反应如下:
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(g)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g)△H=-681.8kJ/mol.

甲乙两同学分别对含+4价硫元素的物质性质进行了探究.
(2)甲用右图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4.
①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变.甲据此得出结论:D中出现白色沉淀的主要原因是酸性条件下,含+4价硫元素物质(SO2或H2SO3)被O2氧化生成SO42-.
(3)乙用如下实验对含+4价硫元素的物质性质继续进行探究.
①用化学方程式解释实验1中产生现象的原因:2H++SO32-═SO2+H2O,2SO2+O2+2Ba2++2H2O═2BaSO4↓+4H+或2H2SO3+O2+2Ba2+═2BaSO4↓+4H+.
②由实验1、2、3对比,可以得到推论含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii.实验1和4对比,乙获得推论:硝酸根离子减慢+4价硫的化合物的氧化;.
(4)已知,25℃时,BaSO4的Ksp为1×10-10,硫酸钡的溶解度约是2.33×10-4g.
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(g)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g)△H=-681.8kJ/mol.

甲乙两同学分别对含+4价硫元素的物质性质进行了探究.
(2)甲用右图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4.
①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变.甲据此得出结论:D中出现白色沉淀的主要原因是酸性条件下,含+4价硫元素物质(SO2或H2SO3)被O2氧化生成SO42-.
(3)乙用如下实验对含+4价硫元素的物质性质继续进行探究.
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL2mol•L-1盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
②由实验1、2、3对比,可以得到推论含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
| 序号 | 实验操作 | 实验现象 |
| 4 | 取固体混合物,向其中加入10mL2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
ii.实验1和4对比,乙获得推论:硝酸根离子减慢+4价硫的化合物的氧化;.
(4)已知,25℃时,BaSO4的Ksp为1×10-10,硫酸钡的溶解度约是2.33×10-4g.
3. 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )| A. | 1mol天然维生素P在一定条件下最多与7molH2加成 | |
| B. | 1mol天然维生素P和溴水反应,可消耗6molBr2 | |
| C. | 可用有机溶剂萃取 | |
| D. | 1mol维生素P可以和4mol NaOH反应 |
20.甲、乙分别是由同主族元素R、Z组成的两种单质,常温下能进行如下反应:甲+乙+H2O→HRO3+HZ(未配平).下列说法不正确的是( )
| A. | 制备1mol HRO3转移电子数一定为2NA | |
| B. | R、Z简单离子的还原性:Z(离子)<R(离子) | |
| C. | HZ分子的稳定性大于HR分子 | |
| D. | HRO3与HZ计量数之比为1:5 |
7.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 6.4gCu与足量的硫反应,转移电子数为0.2 NA | |
| B. | 通常情况下,32g O2和O3的混合气体含有的分子总数小于NA | |
| C. | 6.4g CaC2中含有的离子总数目为0.3NA | |
| D. | 标准状况下,将分子总数为NA的NH3和Cl2充分混合后,所得混合气体体积约为22.4L |
4.下表是元素周期表的一部分,请用化学用语回答:
(1)最高价氧化物对应的水化物中酸性最强的是HClO4.
(2)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)④和⑤元素最高价氧化物对应的水化物相互反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O.
(4)元素②、⑥与氢元素形成的一种化合物含有的化学键类型有离子键、共价键,其电子式为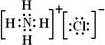 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
(2)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)④和⑤元素最高价氧化物对应的水化物相互反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O.
(4)元素②、⑥与氢元素形成的一种化合物含有的化学键类型有离子键、共价键,其电子式为
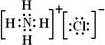 .
.
1.下列化学用语正确的是( )
| A. | 甲基的电子式: | B. | HCl的电子式: | ||
| C. | 中子数为8的碳原子:814C | D. | 丙烷分子的比例模型: |
2.下列关于电解质的说法不正确的是( )
| A. | 一般来说,酸、碱、盐是电解质,非金属氧化物是非电解质 | |
| B. | 常见弱电解质有弱酸、弱碱、水等 | |
| C. | 强电解质的水溶液导电能力一定强,弱电解质的水溶液导电能力一定弱 | |
| D. | 蔗糖、酒精都属于非电解质 |