题目内容
6.图是浓硫酸与金属铜反应的实验装置.请回答下列问题: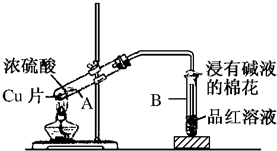
(1)在进行实验前必须要进行的一步操作是检查装置的气密性.
(2)试管B的口部放有一团浸有碱液的棉花,其目的是吸收SO2,防止污染环境.
(3)能说明产物中有SO2生成的现象是B中品红溶液褪色.
(4)铜与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(5)若B中换成I2的淀粉溶液,则溶液蓝色退去,SO2表现的性质是还原性,写出反应的化学方程式I2+SO2+2H2O═H2SO4+2HI.
(6)反应结束后,试管A中还有铜片剩余,待试管冷却后向其中加入NaNO3溶液,有无色气体产生,此时反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
分析 (1)实验室制备气体连接装置后,开始气体制备实验前应先检验装置的气密性;
(2)铜与浓硫酸在加热条件下反应生成二氧化硫,二氧化硫有毒,能引起空气污染,依据二氧化硫为酸性氧化物的性质选择氢氧化钠溶液吸收过量的二氧化硫;
(3)依据二氧化硫的漂白性解答;
(4)铜与浓硫酸在加热条件下反应生成二氧化硫、硫酸铜和水;
(5)依据二氧化硫与碘水反应中硫元素化合价变化判断;
(6)硝酸根离子在酸性环境下具有强的氧化性,能够氧化铜生成硝酸铜,本身被还原为一氧化氮.
解答 解:(1)实验室制备气体连接装置后,开始气体制备实验前应先检验装置的气密性,
故答案为:检查装置的气密性;
(2)铜与浓硫酸在加热条件下反应生成二氧化硫,二氧化硫有毒,能引起空气污染,二氧化硫能够与氢氧化钠溶液反应,被氢氧化钠溶液吸收,防止造成空气污染;
故答案为:吸收SO2,防止污染环境;
(3)二氧化硫具有漂白性,若生成二氧化硫则B中品红溶液褪色;
故答案为:B中品红溶液褪色;
(4)铜与浓硫酸在加热条件下反应生成二氧化硫、硫酸铜和水,方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(5)二氧化硫与碘水反应生成硫酸和氢碘酸,硫元素化合价升高,所以二氧化硫为还原剂,表现还原性,方程式:I2+SO2+2H2O═H2SO4+2HI;
故答案为:还原性,I2+SO2+2H2O═H2SO4+2HI;
(6)硝酸根离子在酸性环境下具有强的氧化性,能够氧化铜生成硝酸铜,本身被还原为一氧化氮,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评 本题考查了实验室制备二氧化硫及性质检验,明确浓硫酸、二氧化硫的性质是解题关键,题目难度不大.

| A. | CH3CH2OH | B. | CO | C. |  | D. | CH2═CH-CH3 |
| A. | CO2 | B. | 氯气 | C. | O3 | D. | SO2 |
| A. | 木炭的燃烧 | B. | 氢氧化钡晶体与氯化铵晶体混合 | ||
| C. | 镁条与稀硫酸的反应 | D. | 生石灰溶于水 |
| A. | 晶体中一定存在化学键 | |
| B. | 已知晶胞的组成就可推知晶体的组成 | |
| C. | 分子晶体在晶体态或熔融态下均不导电 | |
| D. | 原子晶体中只存在共价键,不可能存在其他类型的化学键 |

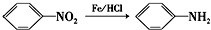 (苯胺,易被氧化)
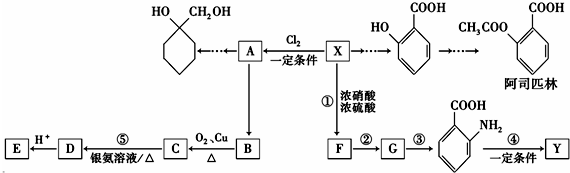
(苯胺,易被氧化)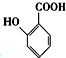 中官能团名称为酚羟基、羧基;
中官能团名称为酚羟基、羧基; ;
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$  +(n-1)H2O;
+(n-1)H2O; 的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2
的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2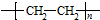
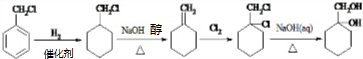 .
. .
.