题目内容
随着大气污染和水污染的日趋严重,国家将二氧化硫(SO2)和氮氧化物(NOx)排放量和生活废水的处理作为环境保护的主要任务.
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,可使主要污染物(CO、NOx、等)进行相互反应,生成无毒物质,减少汽车尾气污染.
①已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g);
△H= .
②在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程中NO (g)、CO(g)、N2(g)的物质的量浓度变化如图一所示,则反应进行到15min时,NO的平均反应速率为 ;
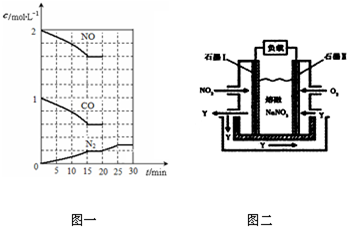
③20min时,若改变反应条件,导致N2浓度发生图一所示的变化,则改变的条件可能是 ;(填字母)
a.加入催化剂 b.降低温度
c.缩小容器体积 d.增加CO2的物质的量
④当25min达到平衡后,若保持体系温度不变,再向容器中充入NO、N2气体各1mol,平衡将 移动(填“向左”、“向右”或“不”).
(2)以NO2、O2、熔融NaNO3组成的燃料电池装置如图二所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为 .
(3)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在硝化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式 .
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2①,NO+NO2+Na2CO3=2NaNO2+CO2②.现用足量的纯碱溶液来吸收硝酸工业尾气(NO和NO2),每产生22.4L(标准状况下)CO2时,吸收液质量增加44g.求硝酸工业尾气中NO和NO2的物质的量之比?(必须写出计算过程)
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,可使主要污染物(CO、NOx、等)进行相互反应,生成无毒物质,减少汽车尾气污染.
①已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g);
△H=
②在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程中NO (g)、CO(g)、N2(g)的物质的量浓度变化如图一所示,则反应进行到15min时,NO的平均反应速率为

③20min时,若改变反应条件,导致N2浓度发生图一所示的变化,则改变的条件可能是
a.加入催化剂 b.降低温度
c.缩小容器体积 d.增加CO2的物质的量
④当25min达到平衡后,若保持体系温度不变,再向容器中充入NO、N2气体各1mol,平衡将
(2)以NO2、O2、熔融NaNO3组成的燃料电池装置如图二所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为
(3)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在硝化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2①,NO+NO2+Na2CO3=2NaNO2+CO2②.现用足量的纯碱溶液来吸收硝酸工业尾气(NO和NO2),每产生22.4L(标准状况下)CO2时,吸收液质量增加44g.求硝酸工业尾气中NO和NO2的物质的量之比?(必须写出计算过程)
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池,反应速率的定量表示方法,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)①根据已知方程推断所解方程,利用盖斯定律获得焓变;
②根据化学反应速率公式v=
可以计算化学反应的速率;
③根据影响化学反应速率的因素来回答;
④先根据三段法求出各自的浓度,然后求出平衡常数和浓度熵,最后根据平衡常数的大小与浓度熵的大小来确定平衡移动方向;
(2)燃料电池的负极上发生燃料失去电子的氧化反应;
(3)加入甲醇,NO3-和甲醇转化为两种无毒气体,可以确定产物是氮气和二氧化碳;
(4)根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
②根据化学反应速率公式v=
| △c |
| △t |
③根据影响化学反应速率的因素来回答;
④先根据三段法求出各自的浓度,然后求出平衡常数和浓度熵,最后根据平衡常数的大小与浓度熵的大小来确定平衡移动方向;
(2)燃料电池的负极上发生燃料失去电子的氧化反应;
(3)加入甲醇,NO3-和甲醇转化为两种无毒气体,可以确定产物是氮气和二氧化碳;
(4)根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
解答:
解:(1)①已知:a:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
b:2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
c:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)可以是2c-a-b得到,所以该反应的焓变=2(-393.5kJ/mol)-180.5kJ/mol-(-221.0kJ/mol)=-746.5 kJ/mol
即NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol,
故答案为:-746.5 kJ/mol;
②反应进行到15min时,NO的平均反应速率v=
=
=0.027 mol?L-1?min-1,故答案为:0.027 mol?L-1?min-1;
③20min时,氮气的浓度迅速增加,说明化学平衡向正方向进行,对于化学平衡:2NO(g)+2CO(g)?N2(g)+2CO2(g)
a.加入催化剂化学平衡不移动,故a错误;
b.降低温度,化学平衡向正方向进行,故b正确;
c.缩小容器体积,即增大压强化学平衡不移动,故c错误;
d.增加CO2的物质的量,化学平衡逆向进行,单质氮气浓度减小,故d错误.
故选c.
④当25min达到平衡后,若保持体系温度不变,再向容器中充入NO、N2气体各1mol,根据浓度熵规则,此时Qc>K,所以化学平衡会逆向移动,故答案为:向左;(2)燃料电池的负极上发生燃料失去电子的氧化反应,即NO2+NO3--e-=N2O5,故答案为:NO2+NO3--e-=N2O5;(
(3)加入甲醇,NO3-和甲醇转化为两种无毒气体,可以确定产物是氮气和二氧化碳,发生的化学反应为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O,故答案为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
(4)设NO的物质的量是x,NO2的物质的量是y,则
x+
=1mol;
32x+24(y-x)=44
解得:x=0.25,y=
;即一氧化氮和二氧化氮的物质的量之比=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,
答:硝酸工业尾气中NO和NO2的物质的量之比1:7.
b:2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
c:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)可以是2c-a-b得到,所以该反应的焓变=2(-393.5kJ/mol)-180.5kJ/mol-(-221.0kJ/mol)=-746.5 kJ/mol
即NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol,
故答案为:-746.5 kJ/mol;
②反应进行到15min时,NO的平均反应速率v=
| △c |
| △t |
| 2mol/L-1.6mol/L |
| 15min |
③20min时,氮气的浓度迅速增加,说明化学平衡向正方向进行,对于化学平衡:2NO(g)+2CO(g)?N2(g)+2CO2(g)
a.加入催化剂化学平衡不移动,故a错误;
b.降低温度,化学平衡向正方向进行,故b正确;
c.缩小容器体积,即增大压强化学平衡不移动,故c错误;
d.增加CO2的物质的量,化学平衡逆向进行,单质氮气浓度减小,故d错误.
故选c.
④当25min达到平衡后,若保持体系温度不变,再向容器中充入NO、N2气体各1mol,根据浓度熵规则,此时Qc>K,所以化学平衡会逆向移动,故答案为:向左;(2)燃料电池的负极上发生燃料失去电子的氧化反应,即NO2+NO3--e-=N2O5,故答案为:NO2+NO3--e-=N2O5;(
(3)加入甲醇,NO3-和甲醇转化为两种无毒气体,可以确定产物是氮气和二氧化碳,发生的化学反应为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O,故答案为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
(4)设NO的物质的量是x,NO2的物质的量是y,则
x+
| y-x |
| 2 |
32x+24(y-x)=44
解得:x=0.25,y=
| 7 |
| 4 |
答:硝酸工业尾气中NO和NO2的物质的量之比1:7.
点评:本题主要考查化学平衡的移动、电极反应以及化学计算,注意平时知识的积累以及灵活应用是解题的关键,难度大,综合性强.

练习册系列答案
相关题目
某金属的硝酸盐受热分解时,生成NO2和O2的物质的量之比是2:1,则在分解过程中金属元素的化合价是( )
| A、升高 | B、降低 |
| C、不变 | D、无法确定 |
某硫原子的质量是a g,12C原子的质量是b g,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为aNA
②m g该硫原子的物质的量为
mol
③该硫原子的摩尔质量是aNA g/mol
④a g该硫原子所含的电子数为16.
①该硫原子的相对原子质量为aNA
②m g该硫原子的物质的量为
| m |
| a |
③该硫原子的摩尔质量是aNA g/mol
④a g该硫原子所含的电子数为16.
| A、①②③ | B、①②④ |
| C、②③④ | D、①③④ |
下列关于I和II的关系叙述中,完全正确的一组是( )
| 选项 | Ⅰ | Ⅱ |
| A | 乙烯和苯都能使溴水褪色 | 苯分子和乙烯分子含有相同的碳碳双键 |
| B | 苯中含有碳碳双键 | 可与H2发生加成反应 |
| C | C2H4、C5H10因组成上相差若干CH2原子团 | 它们互为同系物 |
| D | 苯在一定条件下能与浓硝酸反应 | 属于取代反应 |
| A、选项A | B、选项B |
| C、选项C | D、选项D |
把V L含有Na2SO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为[Al(OH)4]-;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4.则原混合溶液中Na+的浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列叙述正确的是( )
| A、H2O的摩尔质量为18g |
| B、16克CH4含有的分子数为6.02×1023 |
| C、常温、常压下1molNH3的体积约为22.4L |
| D、1L1mol?L-1Na2SO4溶液中含Na+为2mol |
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、0.1 mol/L稀硫酸中含有硫酸根数目为0.1NA |
| B、17.55g NaCl中含有Na+数目为0.25 NA |
| C、2.4g金属镁与足量的盐酸反应,生成氢分子数目为2NA |
| D、1mol NH4+中含有电子数为10NA |