题目内容
19.pH=4的盐酸和氯化铵溶液中,水的电离程度前者与后者比较( )| A. | 大于 | B. | 等于 | C. | 小于 | D. | 无法确定 |
分析 水为弱电解质,水的电离平衡为:H2O?H++OH-,加入酸或碱抑制水的电离,加入能水解的盐促进水的电离,据此进行判断.
解答 解:水为弱电解质,水的电离平衡为:H2O?H++OH-,加入酸或碱抑制水的电离,加入能水解的盐促进水的电离,pH=4的盐酸中水的电离受到抑制,氯化铵溶液中,铵根离子促进了水的电离,所以溶液中水的电离程度:氯化铵溶液大于盐酸溶液,
故选C.
点评 本题考查了水的电离、盐的水解原理,题目难度不大,注意掌握影响水的电离的因素,明确酸碱溶液抑制了水的电离,能够水解的盐促进了水的电离.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
10.下列有机物按系统命名法正确的是( )
| A. | 2,2-二甲基-3-乙基丁烷 | B. | 2-甲基-3-戊烯 | ||
| C. | 2-甲基-2-丙醇 | D. | 2-甲基-2-丁炔 |
10.浓硫酸的危险警告标签是( )
| A. |  | B. |  | C. |  | D. |  |
7.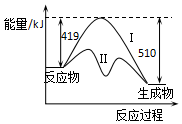 已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )
已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )
 已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )
已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )| A. | 加入催化剂,△H变小 | |
| B. | △H=+91 kJ/mol | |
| C. | 生成1molCH3OH(l)时,△H值增大 | |
| D. | 反应物的总能量大于生成物的总能量 |
4.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比是( )
| A. | 1:1 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
11.下列说法不正确的是( )
| A. | Na与乙醇反应时的反应速率比与水反应时的慢 | |
| B. | 除去乙烷中混有的少量乙烯的方法可以是将其通入溴的四氯化碳溶液中 | |
| C. | 已知 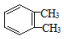 和 和 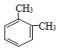 是同一种物质,说明苯分子中的碳碳键不是单双键交替的 是同一种物质,说明苯分子中的碳碳键不是单双键交替的 | |
| D. | .苯不能使酸性高猛酸钾溶液褪色,所以苯不能发生氧化反应 |
8.下列有关硅及其化合物的说法正确的是( )
| A. | 硅酸钠属于盐不属于碱,所以硅酸钠可保存在磨口塞得试剂瓶中 | |
| B. | 反应 Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强 | |
| C. | 普通玻璃,石英玻璃,水泥等均属于硅酸盐材料 | |
| D. | 祖母绿的主要成分是 Be3Al2Si6O18,用氧化物的形式表示为 3BeO•Al2O3•6SiO2 |
9.下列有关化学反应速率的说法中,正确的是( )
| A. | 实验事制氢气时,加入少量NaNO3固体,不影响反应速率 | |
| B. | 锌片分别与等pH的醋酸、硫酸反应,平均反应速率相等 | |
| C. | 升高温度后,吸热反应的速率加快,放热反应的速率减慢 | |
| D. | 纳米铁粉在空气中自燃,是因为纳米铁粉的表面积大 |
 (1)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(写表达式).
(1)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(写表达式).