题目内容
8.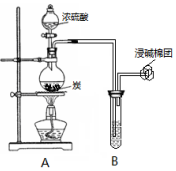 某小组同学利用如图装置开展实验,请回答:
某小组同学利用如图装置开展实验,请回答:(1)装置A中发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+2SO2↑+2H2O.若B中盛装的是紫色石蕊溶液,则B中观察到的现象是紫色石蕊溶液变红.
(2)若B中盛装的是少量氢氧化钡溶液,则B中观察到的现象是有白色沉淀产生.
(3)若B中盛装的是少量新制氯水,则B中观察到的现象是黄绿色褪去,B中发生的主要反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-.若B中盛装的是足量H2O2的水溶液,则B中发生反应的化学方程式为SO2+H2O2=H2SO4.
(4)若B中盛装的是少量品红溶液,则B中观察到的现象是红色褪去.
分析 (1)C与浓硫酸在加热条件下,发生氧化还原反应生成二氧化碳、二氧化硫和水;二氧化碳和二氧化硫都是酸性气体;
(2)二氧化碳和二氧化硫都是酸性氧化物,与氢氧化钡反应分别生成亚硫酸钡和碳酸钡;
(3)二氧化硫具有还原,与氯水反应生成盐酸和硫酸;与过氧化氢反应生成硫酸;
(4)二氧化硫使口红溶液褪色.
解答 解:(1)C与浓硫酸在加热条件下,发生氧化还原反应生成二氧化碳、二氧化硫和水,所以反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+2SO2↑+2H2O;二氧化碳和二氧化硫都是酸性气体,所以B中观察到的现象是紫色石蕊溶液变红,故答案为:C+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+2SO2↑+2H2O;紫色石蕊溶液变红;
(2)二氧化碳和二氧化硫都是酸性氧化物,与氢氧化钡反应分别生成亚硫酸钡和碳酸钡,所以B中观察到的现象是生成白色沉淀,故答案为:有白色沉淀产生;
(3)二氧化硫具有还原,与氯水反应生成盐酸和硫酸,所以若B中盛装的是少量新制氯水,则B中观察到的现象是黄绿色褪去,反应的离子方程式为:Cl2+SO2+2H2O=2HCl+H2SO4,离子反应方程式为:Cl2+SO2+2H2O=4H++2Cl-+SO42-,与过氧化氢反应生成硫酸,化学方程式为:SO2+H2O2=H2SO4,故答案为:黄绿色褪去;Cl2+SO2+2H2O=4H++2Cl-+SO42-;SO2+H2O2=H2SO4;
(4)二氧化硫使口红溶液褪色,所以B 中的现象为红色褪去,故答案为:红色褪去.
点评 本题考查浓硫酸的性质和元素化合物之间的转化,以及反应化学方程式的书写等,非金属与浓硫酸反应生成最高价氧化物,题目难度不大.

| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 纯碱 | 硫酸 | 小苏打 | 氧化钙 | 干冰 |
| B | 烧碱 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
| C | 石灰水 | NaHSO4 | 碳酸钙 | 过氧化钠 | 二氧化碳 |
| D | NH3•H2O | HNO3 | 明矾 | 氧化铁 | SO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 反应速率v(A)=3v(B) | B. | 固体D的物质的量一定 | ||
| C. | 气体的密度不变 | D. | C的浓度不变 |
| A. | 某离子第三层上和第二层上的电子数均为第一层的 4 倍 | |
| B. | Cl-的结构示意图: | |
| C. | 某物质的焰色反应为黄色,某物质一定为钠的化合物 | |
| D. | 14C 和 14N 的质量数相等,互称为同位素 |
| A. | 8 mol/L | B. | 9 mol/L | C. | 11 mol/L | D. | 12 mol/L |
| A. | K越大,达到平衡时,反应进行的越完全 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K不随温度的升高而改变 |
| A. | 0.5mol/L碳酸钠溶液中含有lmolNa+ | |
| B. | 14g氮气和一氧化碳混合气体中含原子总数为NA | |
| C. | 标准状况下,2.24LCCl4物质的量为0.1mol | |
| D. | 56g铁溶于过量的盐酸,电子转移数为3NA |