题目内容
一般检验SO42-的试剂是( )
| A、BaCl2、稀HNO3 |
| B、AgNO3、稀HNO3 |
| C、稀HCl BaCl2 |
| D、AgNO3 稀HCl |
考点:硫酸根离子的检验
专题:
分析:硫酸根离子能与钡离子结合生成硫酸钡沉淀,检验SO42-离子应排除SO32-、CO32-和Ag+的干扰,据此分析解答.
解答:
解:检验硫酸根离子的方法为:取少量溶液于试管中,加入稀盐酸,没有明显现象,排除SO32-、CO32-和Ag+,硫酸根离子能与钡离子结合生成硫酸钡沉淀,再加入氯化钡溶液,产生白色沉淀,则证明溶液中有SO42-,
故选C.
故选C.
点评:本题考查硫酸根离子的检验,明确检验的离子与检验试剂反应时要有明显的实验现象,注意排除某些离子的干扰以及应该加入什么试剂才能排除这些离子的干扰是解答的关键,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
有标准状况下24mL H2和O2的混合气体,在一定条件下点燃后恢复到原状态仅剩余3mL气体(该气体可使带火星木条复燃),则原混合气体中H2和O2的分子个数之比为( )
| A、1:16 | B、16:1 |
| C、17:7 | D、7:5 |
用下列装置进行相应实验,能达到实验目的是( )
A、 用图能证明酸性:硫酸>碳酸>次氯酸 |
B、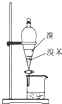 用图所示装置分离出溴苯 |
C、 用图设计成铜锌原电池装置 |
D、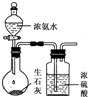 用图制取干燥的氨气 |
下列仪器:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥烧杯 ⑦试管,常用于物质分离的是( )
| A、①③④ | B、①②⑥ |
| C、①③⑤ | D、③④⑦ |
下列反应属于加成反应的是( )
| A、2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |||
B、 +HNO3 +HNO3
 +H2O +H2O | |||
C、CH3CH=CH2+Br2→ | |||
| D、CH3COOH+CH3CH2OH→CH3COOCH2CH3+H2O |
二氯化二硫(S2Cl2)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H2O2相似,熔点为193K,沸点为411K,遇水很容易反应,产生的气体能使品红褪色,S2Cl2可由干燥的氯气通入熔融的硫中制得.下列有关说法不正确的是( )
| A、S2Cl2分子中各原子均达到8电子稳定结构 |
| B、制备S2Cl2的反应是化合反应,不是氧化还原反应 |
| C、S2Cl2遇水反应的化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl |
| D、S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 |
下列分子中所有原子不可能共同处在同一平面上的是( )
A、 |
| B、HC≡C-C≡CH |
| C、CH2=CHCl |
| D、H2CO3 |
下列有关电解质溶液中粒子浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D、NaHCO3溶液:c(H+)+c(HCO3-)+c(CO32-)=c(OH-) |
下列说法正确的是( )
A、根据反应Cu+H2SO4
| ||||
| B、电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次顺依次是Cu2+、H+、Pb2+ | ||||
| C、含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体 | ||||
| D、因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |