题目内容
1.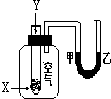 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )| A. | ①②③ | B. | ①③ | C. | ①② | D. | ②③ |
分析 当往试管中加入试剂Y时,看到U型管中液面甲处下降,乙处上升,可以根据大气压强原理以及气体热胀冷缩的性质来回答.
解答 解:当往试管中加入试剂Y时,看到U型管中液面甲处下降,乙处上升,说明该反应是放热反应,放出的热使得集气瓶中气压升高而出现该现象,故①正确,在放热反应中,反应物的能量高于生成物的能量,故②错误;该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来,故③正确.
故选B.
点评 本题是一道关于吸热反应和放热反应知识的题目,可以根据所学知识进行回答,难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
12.下列物质中,不属于合金的是( )
| A. | 水银 | B. | 黄铜 | C. | 钢铁 | D. | 生铁 |
9.下列化学用语正确的是( )
| A. | NaHCO3 的电离:NaHCO3═Na++H++CO32- | |
| B. | HS-的电离:HS-+H2O?H3O ++S2- | |
| C. | NaClO的电离:NaClO?Na++ClO- | |
| D. | NH4Cl水解方程式 NH4++H2O═NH3•H2O+H+ |
16.正确认识官能团有助于了解有机物的性质,下列有关物质官能团的说法正确的是( )
| A. | 油脂分子中都含有碳碳双键 | B. | 葡萄糖分子中含有羟基和醛基 | ||
| C. | 水分子中含有羟基 | D. | 乙酸乙酯分子中含有羧基 |
1.Cu2S 可用于制防污涂料,其可由热的铜在硫蒸气或H2S 中反应制得.
(1)铜元素在元素周期表中的位置为第四周期ⅠB族,Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10,基态铜原子核外电子共有29种运动状态.
(2)Cu2S在一定条件下可被氧化为CuSO4.
①在SO42-中S原子的杂化轨道类型为sp3;SiO44-、PO43-与 SO42-互为等电子体;其中Si、P、S第一电离能由大到小顺序为P>S>Si;
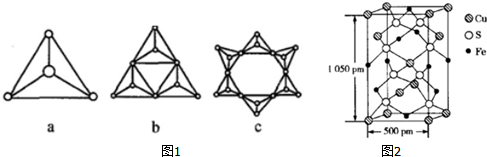
②硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以用图1a 表示,图1中b、c 是硅氧四面体结合成环状结构的两个例子,若在环状结构中硅的原子数为n,写出环状结构中硅酸根离子的通式SinO3n2n-.
(3)甲醇(CH3OH)中的羟基被硫羟基取代生成甲硫醇(CH3SH),二者部分物理性质如表:
甲醇和甲硫醇在熔沸点和水溶性方面性质差异的原因是CH3OH与CH3OH分子、CH3OH与水分子间易形成氢键,导致其熔沸点较高,且易溶于水;而CH3SH中S的电负性小,不能形成氢键.
(4)某化合物由S、Fe、Cu 三种元素组成,其晶胞结构如图2所示(1pm=10-10cm),该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度ρ=4.66g/cm3(保留三位有效数字).
(1)铜元素在元素周期表中的位置为第四周期ⅠB族,Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10,基态铜原子核外电子共有29种运动状态.
(2)Cu2S在一定条件下可被氧化为CuSO4.
①在SO42-中S原子的杂化轨道类型为sp3;SiO44-、PO43-与 SO42-互为等电子体;其中Si、P、S第一电离能由大到小顺序为P>S>Si;
②硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以用图1a 表示,图1中b、c 是硅氧四面体结合成环状结构的两个例子,若在环状结构中硅的原子数为n,写出环状结构中硅酸根离子的通式SinO3n2n-.

(3)甲醇(CH3OH)中的羟基被硫羟基取代生成甲硫醇(CH3SH),二者部分物理性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 水溶液 |
| 甲醇 | -97 | 64.7 | 互溶 |
| 甲硫醇 | -123 | 6.8 | 不溶 |
(4)某化合物由S、Fe、Cu 三种元素组成,其晶胞结构如图2所示(1pm=10-10cm),该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度ρ=4.66g/cm3(保留三位有效数字).
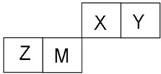 X、Y、Z、W四种短周期元素在周期表中的位置如右图,其中只有Z为金属元素.回答下列问题:
X、Y、Z、W四种短周期元素在周期表中的位置如右图,其中只有Z为金属元素.回答下列问题: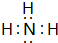 ,该气态氢化物可以用浓盐酸来检验,其反应产物的化学式为NH4Cl,所得产物中包含的化学键为离子键、共价键.
,该气态氢化物可以用浓盐酸来检验,其反应产物的化学式为NH4Cl,所得产物中包含的化学键为离子键、共价键.