题目内容
18.类推是学习和研究的重要思维方法.下列类推结论正确的是( )| 选项 | 化学事实 | 类推结论 |
| A | Al在O2中燃烧生成Al2O3 | Fe在O2中燃烧也生成Fe2O3 |
| B | 用分别蘸取了浓盐酸和浓氨水的两根玻璃棒相互靠近不接触,可看到白烟 | 用分别蘸取了浓硫酸和浓氨水的两根玻璃棒相互靠近不接触,可以看到白烟 |
| C | 电解熔融MgCl2的方法冶炼金属镁 | 电解熔融NaCl的方法制取金属钠 |
| D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、铝在氧气中燃烧生成最高价氧化物,而燃烧生成是四氧化三铁;
B、浓盐酸具有挥发性,浓硫酸没有;
C、工业上制得活泼金属,都是电解熔融的盐而在阴极得到金属;
D、SO2通入BaCl2溶液中无沉淀生成,是弱酸不能制强酸,而SO2通入Ba(NO3)2溶液中发生了氧化还原反应,生成了白色的硫酸钡沉淀
解答 解:A、铁燃烧生成是四氧化三铁,方程为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,所以类推错误,故A不选;
B、浓盐酸具有挥发性,和浓氨水的两根玻璃棒相互靠近不接触,可看到白烟,浓硫酸没有挥发性,和浓氨水的两根玻璃棒相互靠近不接触,看不到白烟,故B不选;
C、工业上制得活泼金属,都是电解熔融的盐而在阴极得到金属,以制钠为例,方程式为2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,故C选;
D、SO2通入Ba(NO3)2溶液中发生了氧化还原反应,生成了白色的硫酸钡沉淀,离子方程式为4H2O+3SO2+3Ba2++NO3-=3BaSO4↓+NO↑+8H+,故D不选;
故选C.
点评 本题考查有关元素及其化合物性质的类比,要解决此类问题必须在熟练掌握元素及化合物性质的基础上,才能得心应手!

练习册系列答案
相关题目
9.下列有关说法不正确的是( )
| A. | “凡造竹纸…用上好石灰化汁涂浆”,造纸利用了石灰的碱性 | |
| B. | “曾青(硫酸铜)涂铁,铁赤色如铜”,过程中发生了罝换反应 | |
| C. | 人民币防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料 | |
| D. | 含钙镁离子的硬水均可通过煮沸的方法使之软化 |
6. 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | 0-a段发生反应:3 HSO3-+IO3-═3SO42-+I-+3H+ | |
| B. | a~b段共消耗NaHSO3的物质的量为1.8mol | |
| C. | b~c段反应:氧化产物为I2 | |
| D. | 当溶液中I-与I2的物质的量之比为5:1时,加入的KIO3为1.lmol |
13.下列反应的离子方程式正确的是( )
| A. | 用氨水溶解氯化银沉淀:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| B. | Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-═Mg CO3↓+CO32-+2H2O | |
| C. | Na2O2固体投入H218O中:2H218O+2Na2O2=4Na++4OH-+18O2↑ | |
| D. | 苯酚钠溶液跟AlCl3溶液反应:3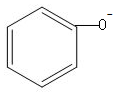 +Al3++3H2O→ +Al3++3H2O→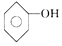 +Al(OH)3↓ +Al(OH)3↓ |
5.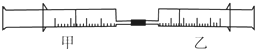 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )
 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )| 实验序号 | 甲针筒内物质 | 乙针筒内物质 |
| 1 | 10mL HCl | 10mL NH3 |
| 2 | 30mL NO2 | 10mL H2O(液) |
| 3 | 20mL HBr | 10mL Cl2 |
| 4 | 10mL CCl4 | 10mL NH3 |
| A. | 上述4个实验均发生了氧化还原反应 | |
| B. | 实验2,甲针筒内最终的无色气体是NO | |
| C. | 实验3,甲针筒内充满黄绿色气体 | |
| D. | 实验4,甲针筒内活塞将向右移动 |
12.根据实验操作和现象所得出的结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向NaAlO2溶液中滴入NaHCO3溶液 | 有白色沉淀生成 | AlO2-结合H+的能力比CO32-强 |
| B | 向某溶液中滴入氯水,再滴加KSCN溶液 | 溶液显血红色 | 原溶液中一定有Fe2+ |
| C | 向某无色溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| D | 用洁净的铂丝蘸取某溶液进行焰色反应 | 火焰呈黄色 | 原溶液中一定有Na+、无K+ |
| A. | A | B. | B | C. | C | D. | D |
9.下列各组物质中,每一种物质都能使氯水褪色的是( )
| A. | AgNO3溶液、CCl4、BaCl2溶液 | B. | Na2SO3溶液、FeCl3溶液、H2S溶液 | ||
| C. | SO2气体、KOH溶液、镁粉 | D. | NaOH溶液、CO气体、石蕊溶液 |
 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.