题目内容
18.下列说法正确的是( )| A. | 制普通玻璃的主要原料是烧碱、石灰石、石英 | |
| B. | SiO2是光导纤维的主要成分,晶体硅可用于制作半导体材料 | |
| C. | 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液 | |
| D. | 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |
分析 A.制普通玻璃的主要原料为纯碱而不是烧碱;
B.二氧化硅具有全反射的性能,晶体硅可导电;
C.玻璃中的二氧化硅可与氢氧化钠溶液反应;
D.盐酸与硅不反应.
解答 解:A.制普通玻璃的主要原料为纯碱而不是烧碱,纯碱与二氧化硅反应生产硅酸钠,为玻璃的主要成分,故A错误;
B.二氧化硅具有全反射的性能,可用于光导纤维,晶体硅可导电,可用于半导体材料,故B正确;
C.玻璃中的二氧化硅可与氢氧化钠溶液反应,应用橡胶塞,故C错误;
D.盐酸与硅不反应,故D错误.
故选B.
点评 本题综合考查物质的组成、性质与应用,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.在NaCl和Na2SO4的混合溶液中,Na+、SO42-、Cl-的物质的量浓度之比不可能出现的是( )
| A. | 8:3:2 | B. | 6:2:3 | C. | 5:2:1 | D. | 3:1:1 |
9.下列有关化学用语表示错误的是( )
| A. | HCN的结构式:H-C≡N | |
| B. | HClO的电子式: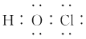 | |
| C. | 质子数为86、中子数为51的铯原子:86137Cs | |
| D. | S2-的结构示意图: |
6.下列化合物进行硝化时,反应的活性最大的是( )
| A. | 甲苯 | B. | 间二甲苯 | C. | 对二甲苯 | D. | 苯 |
13. 硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
(I)以含铁的铜屑为原料制备Cu ( NO3 ) 2•3H2O的实验过程如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稀过量HNO_{3}}$溶液Ⅰ$→_{步骤Ⅱ}^{加入X}$溶液II…→Cu(NO3)2•3H2O
已知几种离子生物生成氢氧化物沉淀的pH如表
(1)铜与稀HNO3反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)请补充完整由溶液I制备Cu ( NO3 ) 2•3H2O晶体的实验方案:
①往溶液I中加入物质x,调节溶液的pH,其中物质X的化学式为:CuO或Cu(OH)2或Cu2(OH)2CO3,调节溶液的pH范围为:3.2≤pH<4.7,若加入的物质X太少,溶液II中会含有较多的杂质离子,检验溶液II中含有较多该杂
质离子的实验操作方法是:取少量溶液II于试管中,滴入几滴KSCN溶液,若溶液变红,则证明溶液II中含有较多杂质离子
②溶液II经过蒸发浓缩、冷却结晶,过滤,用冰水洗涤,干燥得到
Cu ( NO3 ) 2•3H2O晶体.
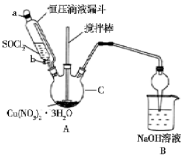
(II)用Cu ( NO3 ) 2•3H2O晶体和SOC12制备无水Cu ( NO3 ) 2的实验装置(夹持及控提装置省略)如图所示,已知SOC12熔点为-105℃,沸点为76℃,遇水剧烈水解生成两种酸性气体:
(1)①仪器c的名称是:三颈烧瓶.
②装置A中使用恒压滴液漏斗的优点是:维持滴液漏斗内部与三颈烧瓶中气体压强相等,便于溶液顺利滴下
(2)装置A中Cu ( NO3 ) 2•3H2O晶体和SOC12在加热条件下发生反应的化学方程式是:Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCl↑.
 硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题(I)以含铁的铜屑为原料制备Cu ( NO3 ) 2•3H2O的实验过程如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稀过量HNO_{3}}$溶液Ⅰ$→_{步骤Ⅱ}^{加入X}$溶液II…→Cu(NO3)2•3H2O
已知几种离子生物生成氢氧化物沉淀的pH如表
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
(2)请补充完整由溶液I制备Cu ( NO3 ) 2•3H2O晶体的实验方案:
①往溶液I中加入物质x,调节溶液的pH,其中物质X的化学式为:CuO或Cu(OH)2或Cu2(OH)2CO3,调节溶液的pH范围为:3.2≤pH<4.7,若加入的物质X太少,溶液II中会含有较多的杂质离子,检验溶液II中含有较多该杂
质离子的实验操作方法是:取少量溶液II于试管中,滴入几滴KSCN溶液,若溶液变红,则证明溶液II中含有较多杂质离子
②溶液II经过蒸发浓缩、冷却结晶,过滤,用冰水洗涤,干燥得到
Cu ( NO3 ) 2•3H2O晶体.
(II)用Cu ( NO3 ) 2•3H2O晶体和SOC12制备无水Cu ( NO3 ) 2的实验装置(夹持及控提装置省略)如图所示,已知SOC12熔点为-105℃,沸点为76℃,遇水剧烈水解生成两种酸性气体:
(1)①仪器c的名称是:三颈烧瓶.
②装置A中使用恒压滴液漏斗的优点是:维持滴液漏斗内部与三颈烧瓶中气体压强相等,便于溶液顺利滴下
(2)装置A中Cu ( NO3 ) 2•3H2O晶体和SOC12在加热条件下发生反应的化学方程式是:Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCl↑.
3.下列有关实验操作、现象和目的或结论的说法正确的是( )
| 选项 | 操作 | 目的或结论 |
| A | 将Fe(NO3)2晶体溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变化 | 检验Fe(NO3)2样品是否已被氧化而变质 |
| B | 海带提碘实验中,为了制取海带灰的浸取液,需要煮沸海带灰和水的混合物1-2min | 主要目的是去除溶液中的氧气,避免氧气氧化碘离子 |
| C | 在试管中依次加入2mL浓硫酸、3mL乙醇和2mL乙酸,用酒精灯缓慢加热 | 制备乙酸乙酯 |
| D | 向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分震荡,白色固体溶解 | NH4+与Mg(OH)2溶解出的OH-结合,导致Mg(OH)2溶解 |
| A. | A | B. | B | C. | C | D. | D |
10.X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如表:
则相关判断正确的是( )
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z元素的原子最外层有3个电子 |
| W | W的一种核素的质量数为28,中子数为14 |
| A. | W原子半径大于Z | |
| B. | 氢元素可以与X、Y分别形成的二元化合物分子间容易形成氢键 | |
| C. | 向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量无现象 | |
| D. | W的单质与氢氟酸反应生成两种无色气体 |
12.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CO32- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Na+、SO42-、Cl-、NH4+ |