题目内容
2.银-Ferrozine法检测甲醛(HCHO)的原理为①在原电池装置中,氧化银能将甲醛充分氧化为CO2;②Fe3+与产生的Ag定量反应生成Fe2+;③Fe2+与Feirozine形成有色配合物;④测定溶液的吸光度(吸光度与溶液中有色物质的浓度成正比).下列说法正确的是( )| A. | ①中,负极上消耗1 mol甲醛时转移2 mol电子 | |
| B. | ①溶液中的H+由正极移向负极 | |
| C. | 理论上消耗的甲醛与生成的Fe2+的物质的量之比为1:4 | |
| D. | ④中,甲醛浓度越大,吸光度越小 |
分析 A.根据甲醛中元素的化合价的变化判断;
B.原电池中阳离子向正极移动;
C.根据电子守恒计算;
D.吸光度与溶液中有色物质的浓度成正比.
解答 解:A.甲醛充分氧化为CO2,碳元素的化合价从0价升高到+4价,则负极上消耗1 mol甲醛时转移4 mol电子,故A错误;
B.原电池中阳离子向正极移动,则①溶液中的H+由负极移向正极,故B错误;
C.甲醛充分氧化为CO2,碳元素的化合价从0价升高到+4价,转移电子数为4,Fe3+反应生成Fe2+转移电子数为1,则理论上消耗的甲醛与生成的Fe2+的物质的量之比为1:4,故C正确;
D.甲醛浓度越大,反应生成的Fe2+的物质的量浓度越大,形成有色配合物的浓度越大,吸光度越大,故D错误.
故选C.
点评 本题考查了原电池原理的应用、氧化还原反应等,题目难度中等,侧重于考查学生的分析能力和应用能力,注意把握题干中的信息以及氧化还原反应的分析方法.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
13.下列做法中不会影响食品安全的是( )
| A. | 把色彩鲜艳的着色剂添加到婴幼儿食品中 | |
| B. | 做菜时用适量的食盐、味精和醋调味 | |
| C. | 把发霉的大米晒干并淘洗干净后做成甜酒上市销售 | |
| D. | 把过期食品下架回收,重新喷码后再上架销售 |
17.下列反应的离子方程式书写正确的是( )
| A. | 将Al条投入NaOH溶液中:Al+4OH-=AlO2-+2H2O | |
| B. | 铜溶于浓硫酸中并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 碳酸氢钙溶液中加入少量氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀硫酸:CO32-+H+=HCO3- |
7.下列关于现象的说法正确的是( )
| A. | 向某溶液中加入氯水再滴加KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ | |
| B. | 取某溶液进行焰色反应,透过蓝色钻玻璃焰色为紫色,则原溶液的溶质一定是KNO3 | |
| C. | 向某溶液中加入BaCl2溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液不一定含有SO42- | |
| D. | 往Na2CO3和NaHCO3溶液中滴加酚酞都变红,说明Na2CO3和NaHCO3都是碱 |
14.将100gNa2CO3和NaHCO3的混合物用酒精灯加热至质量不再变化时,固体质量减少到75.2g.此混合物中Na2CO3的质量分数是( )
| A. | 75.2% | B. | 67.2% | C. | 41.7% | D. | 32.8% |
12.下列解释实验事实的方程式中,不准确的是( )
| A. | 在CH3COONa 溶液中滴入无色酚酞,溶液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| C. | 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3=Na++H++SO32- | |
| D. | 在草酸溶液中滴入几滴稀H2SO4酸化的KMnO4溶液,溶液无色:2MnO4-+5H2C2O4+6H +=2Mn2++10CO2↑+8H2O |
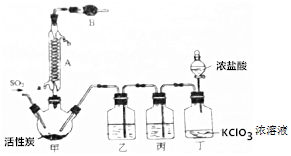
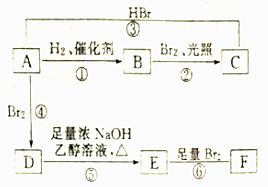
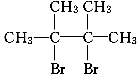
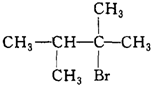 .
. ;写出由E→F的化学方程式
;写出由E→F的化学方程式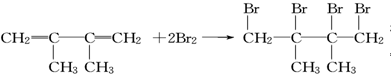 .
.