题目内容
15.乙烯是重要的工业原料,下列有关乙烯叙述不正确的是 ( )| A. | 常温常压下是气体 | B. | 能使溴的四氯化碳溶液褪色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 在一定条件下能够聚合生成聚乙烯 |
分析 乙烯为气体,且含碳碳双键,能发生加成、氧化反应,且可发生加聚反应生成高分子,以此来解答.
解答 解:A.乙烯是碳原子数小于5的烃,常温常压下是气体,故A正确;
B.乙烯能与溴发生加成反应,生成无色的1,2-二溴乙烷,能使溴的四氯化碳溶液褪色,故B正确;
C.乙烯含有双键,性质较活泼,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故C错误;
D.乙烯含有双键,所以在一定条件下能发生加聚反应生成聚乙烯,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应类型,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.2014年《RSC Advances》报道了一种全陶瓷固体氧化物铁-空气电池,工作原理如图所示:

下列说法正确的是( )

下列说法正确的是( )
| A. | 该电池常温下可稳定工作 | |
| B. | 放电时,电能转变为化学能 | |
| C. | 充电时,阳极发生反应:4OH--4e-═2H2O+O2↑ | |
| D. | 放电时,负极室发生反应:Fe+xH2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeOx+xH2,负极发生反应:H2+O2--2e-=H2O |
3.元素X和Y是同周期主族元素,X元素在第ⅠA族,Y元素在第ⅦA族,则X和Y两元素原子序数之差不可能是( )
| A. | 6 | B. | 16 | C. | 26 | D. | 30 |
10.常温下,下列物质能用铝制器皿盛放的是( )
| A. | 稀硫酸 | B. | 氢氧化钠溶液 | C. | 稀硝酸 | D. | 浓硝酸 |
20.用括号内的试剂除去下列各物质中的少量杂质,其中最优的是( )
| A. | 溴苯中的Br2(氢氧化钠溶液) | B. | 苯中的甲苯(浓溴水) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 甲烷中的乙炔 (H2) |
7.下列不能证明Cl元素的非金属性强于S元素的是( )
| A. | HCl的稳定性强于H2S | |
| B. | Cl元素最高正价为+7,而S元素最高正价为+6 | |
| C. | 将Cl2通入Na2S溶液中,产生黄色沉淀 | |
| D. | 单质与H2化合所需的反应条件,S比Cl2苛刻 |
6.下列有关说法正确的是( )
| A. | 升温时水的电离程度会增大,某温度下,pH═7的纯水中OH-浓度可能为10-6mol/L | |
| B. | 室温下,对于0.10 mol/L的醋酸,用NaOH溶液完全中和后,溶液不显中性 | |
| C. | HSO4-既能电离又能水解,且能与强碱溶液反应 | |
| D. | CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(OH-)的值增大 |
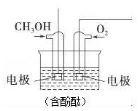 将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:
将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题: