题目内容
4.材料是人类社会发展的物质基础,材料科学的发展离不开化学.①黏土是陶瓷的生产原料,其中江苏宜兴的高岭土是含有杂质较少的高品质黏土,其主要组成可表示为Al2Si2Ox(OH)4,则x=5.
②2016年奥运会在巴西举行,场馆的建设需大量的建筑材料.其中生产水泥、玻璃共同的原料是碳酸钙(填名称),场馆内的座椅通常用高密度聚乙烯(HDPE)为原料制得,聚乙烯属于热塑性塑料(填“热固性”或“热塑性”).
③沪通铁路建设正在积极推进,其中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一.铁在发生电化学腐蚀时的负极反应方程式为Fe-2e-=Fe2+.
④工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,并于2000℃下拉成光纤细丝.该反应的化学方程式为SiCl4+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+2Cl2.
分析 ①依据化合物中各种元素化合价代数和为0计算解答;
②水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英,所以原料中均有石灰石即碳酸钙,据此分析解答;聚乙烯为线型结构;
③在电化学腐蚀中,负极是金属发生失电子的氧化反应;
④SiCl4与O2在高温条件下通过置换反应制得SiO2,根据置换反应的概念来分析反应产物.
解答 解:①铝、硅、氧、氢氧根分别显+3价、+4价、-2价、-1价,依据化合物中各元素的化合价代数和为0,则有(+3)×2+(+4)×2+(-2)×x+(-1)×4=0,即x=5,
故答案为:5;
②生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥.所以在玻璃工业、水泥工业中都用到的原料是石灰石即碳酸钙;聚乙烯为线型结构,故为热塑性塑料,
故答案为:碳酸钙;热塑性;
③金属的电化学腐蚀分为吸氧腐蚀和析氢腐蚀,以吸氧腐蚀更为普遍,在两种电化学腐蚀中,负极都是金属铁发生失电子的氧化反应,即Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
④SiCl4与O2在高温条件下通过置换反应制得SiO2,由于置换反应的概念是一种单质和一种化合物反应生成另一种单质和另一种化合物,故SiCl4与O2在高温条件下除了生成SiO2还生成氯气,故化学方程式为:SiCl4+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+2Cl2,故答案为:SiCl4+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+2Cl2.
点评 本题考查了硅酸盐工业的原料、化学方程式的书写和电化学腐蚀,应注意的是无论是钢铁的吸氧腐蚀还是析氢腐蚀,负极都是金属铁发生失电子的氧化反应.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. | α粒子 | B. | 质子 | C. | 中子 | D. | ${\;}_{1}^{1}$ H |
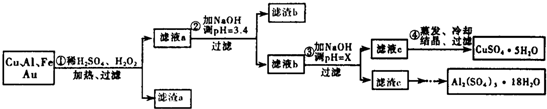
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH3) | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是Cu+H2O2+2H+═Cu2++2H2O.
(3)滤渣a的主要成分是Au.
(4)步骤③中X的取值范围是5.2≤X<5.4.
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点.共消耗14.00mL
Na2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2${S_2}O_3^{2-}$+I2═2I-+${S_4}O_6^{2-}$
①样品中硫酸铜晶体的质量分数为87.5%.
②该组乙同学提出通过直接测定样品中$SO_4^{2-}$的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是样品中含有Na2SO4等杂质.
(6)请你设计一个由滤渣c得到Al2(SO4)3•18H2O的实验方案将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体.
| A. | 汽油燃烧 | B. | 铝热反应 | C. | 液氨汽化 | D. | 酸碱中和 |
| A. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 硅酸钠与稀硫酸反应:Na2SiO3+2H+═2Na++H2SiO3↓ |
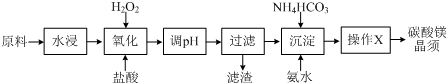
已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.9 | 11.1 |
(1)写出“氧化”过程中发生的离子反应方程式并用单线桥标出电子转移的方向和数目
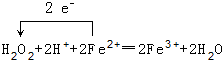 .
.(2)pH调节的范围3.7~9.9之间,滤渣的主要成分Fe(OH)3(填化学式).
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法取最后一次洗涤液,加入硝酸酸化,再加入硝酸银溶液,没有白色沉淀生成,说明洗涤干净.
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00mL,测得Cl-的浓度为0.455mol•L-1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl-的浓度为0.460mol•L-1(溶液体积变化忽略不计).
②另取水浸后溶液100.00mL,向其中加入过量的1mol•L-1NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96g.
试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度(写出计算过程).
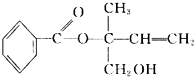
| A. | 有机物M和油脂都含有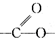 ,两者在酸性或碱性条件下都能发生取代反应 ,两者在酸性或碱性条件下都能发生取代反应 | |
| B. | M在一定条件下能发生加聚反应,不能发生酯化反应 | |
| C. | 在Ni作催化剂的条件下,1 mol M最多只能与1molH2加成 | |
| D. | 不可用酸性高锰酸钾溶液区分苯和M |
(1)已知:
C(石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-111kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H2=-242kJ/mol
C(石墨)+O2(g)=CO2(g)△H3=-394kJ/mol
请写出一氧化碳那与水作用转化为氢气和二氧化碳反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol;
(2)能判断该反应达到化学平衡状态的依据是( )(填序号);
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)已知一氧化碳与水作用转化为氢气和二氧化碳的化学平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(4)为使该反应的速率增大且平衡向正反应方向移动,可采取的措施是A.
A.增大CO浓度 B.升高温度
C.将生成物分离出去 D.使用高效催化剂.

| A. | 用有机溶剂从青蒿中提取青蒿素,主要采用萃取的方法 | |
| B. | 青蒿素的分子式为C15H22O5 | |
| C. | 青蒿素通过还原反应可制得双氢青蒿素 | |
| D. | 青蒿素和双氢青蒿素都是芳香族化合物 |