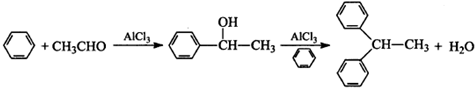
题目内容
14.2015年10月,中国女药学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素的贡献获得诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如下图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
| A. | 用有机溶剂从青蒿中提取青蒿素,主要采用萃取的方法 | |
| B. | 青蒿素的分子式为C15H22O5 | |
| C. | 青蒿素通过还原反应可制得双氢青蒿素 | |
| D. | 青蒿素和双氢青蒿素都是芳香族化合物 |
分析 A.青蒿素易溶于有机溶剂;
B.由结构可知青蒿素的分子式;
C.青蒿素含有C=O键,与氢气发生加成反应生成C-O;
D.都不含有苯环.
解答 解:A.青蒿素易溶于有机溶剂,为萃取的分离方法,故A正确;
B.由结构简式可知青蒿素的分子式为C15H22O5,故B正确;
C.青蒿素含有C=O键,与氢气发生加成反应生成C-O,为还原反应,故C正确;
D.都不含有苯环,不是芳香族化合物,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃的加成反应为还原反应,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
2.著名的“侯氏制碱法”的第一步反应是向饱和食盐水中通入CO2而析出NaHCO3,该反应可表示为:NH3+NaCl+CO2+H2O═NaHCO3↓+NH4Cl
已知NaCl、NaHCO3、NH4Cl如下温度的溶解度:
今在40℃时,向434g饱和食盐水中通入44.8L(标准状况)NH3,再向溶液中通入过量的CO2,求:
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
已知NaCl、NaHCO3、NH4Cl如下温度的溶解度:
| 物质 | NaCl | NaHCO3 | NH4Cl |
| 40℃时溶解度/g | 37 | 13 | 46 |
| 10℃时溶解度/g | 33 |
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
9.锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中.下列说法正确的是( )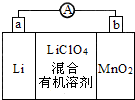

| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-=MnO2- | |
| C. | 用稀硫酸代替有机溶剂,增加自由移动的离子浓度,可以增加电池的电流强度 | |
| D. | Li+通过电解质迁移入MnO2晶格中,生成LiMnO2 |
6.能在水溶液中大量共存的离子组是( )
| A. | H+、Fe3+、SO42-、I- | B. | H+、NH4+、HCO3-、NO3- | ||
| C. | K+、AlO2-、Cl-、OH- | D. | Ag+、K+、Cl-、SO42- |
3.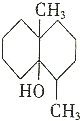 当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )
当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )
 当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )
当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )| A. | 金属钠 | B. | 醋酸和浓硫酸的混合溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 碳酸钠溶液 |
5.关于重结晶的说法,错误的是( )
| A. | 被重结晶提纯的物质的溶解度随温度变化大 | |
| B. | 溶解度很小的杂质留在了热滤的滤渣里 | |
| C. | 重结晶的步骤为:加热溶解、冷却过滤、结晶 | |
| D. | 重结晶的首要工作是选择适当的溶剂 |